例题:实验气体配置 ■ 根据分压定律充气:首先抽真空,压力表显示封闭容器中 的压力为P-0atm;接下来充CH4,直到压力表显示压力 为P=xcH4atm时停止充气;接下来充O2,直到压力表显示 压力为P=(xcH4+xo2)atm时停止充气;最后充N2,直到压 力表显示压力为P=1atm时停止充气。 ■ 思考题:低压实验,各组分分压很低,而压力表精度不够 高怎么办? 高速摄像机 光学纹影 压力表 @pku.edu.cn)】 17
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 例题:实验气体配置 17 根据分压定律充气:首先抽真空,压力表显示封闭容器中 的压力为P=0 atm;接下来充CH4,直到压力表显示压力 为P=xCH4 atm时停止充气;接下来充O2,直到压力表显示 压力为P=(xCH4+xO2) atm时停止充气;最后充N2,直到压 力表显示压力为P=1 atm时停止充气。 思考题:低压实验,各组分分压很低,而压力表精度不够 高怎么办?
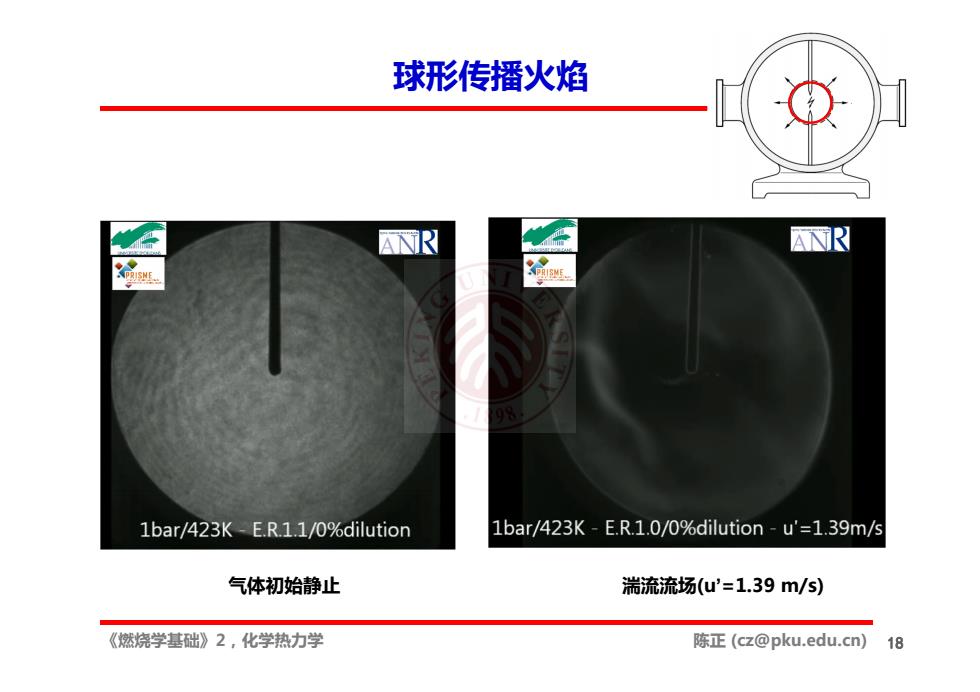
球形传播火焰 R 丽R 1bar/423K-E.R.1.1/0%dilution 1bar/423K-E.R.1.0/0%dilution-u'=1.39m/s 气体初始静止 湍流流场(u'=1.39m/s) 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 18
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 球形传播火焰 18 气体初始静止 湍流流场(u’=1.39 m/s)

例题:实验气体配置 ■实验设计,CH /airi混合气体,当量比为b=0.8 ■φCH4+202+3.76N2) p 2 +2×4.76 p+2×4.76 XN2=1-XCH4-X02 ■ 实验:上述预混气体在开口玻璃管中形成静止火焰(定常问题) 相机 /89 火焰 玻璃管 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn)19
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 例题:实验气体配置 19 实验设计,CH4/air混合气体,当量比为=0.8 CH4 + 2(O2 + 3.76N2) 实验II:上述预混气体在开口玻璃管中形成静止火焰(定常问题) ? 相机 玻璃管 ( 火焰 76.42 4 xCH = 76.422 2 xO = N 2=1 CH xxx O24
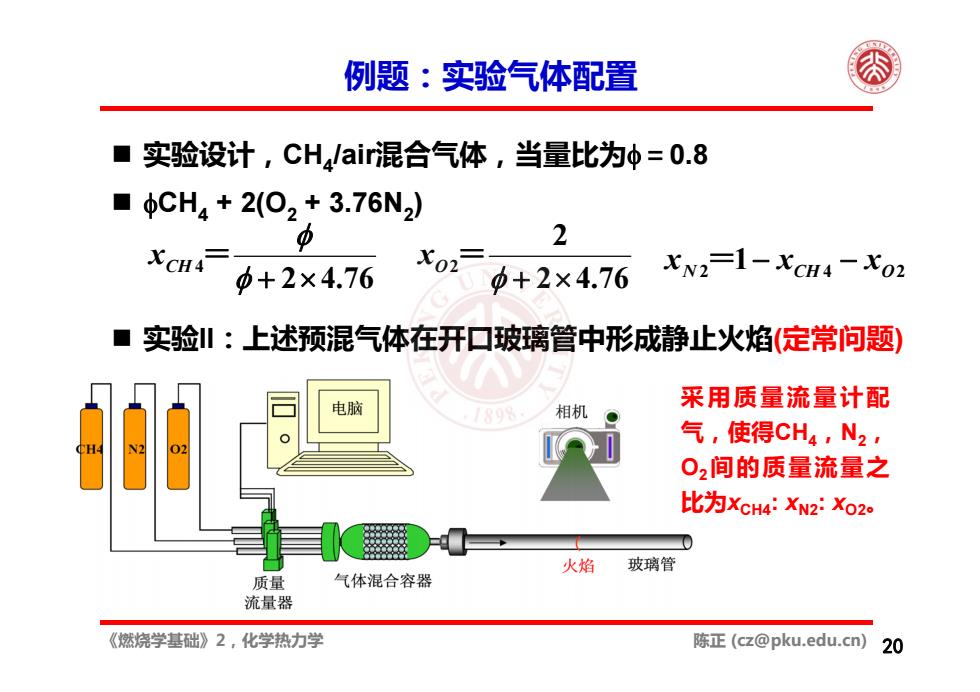
例题:实验气体配置 ■实验设计,CH /airi混合气体,当量比为φ=0.8 ■φCH4+2(O2+3.76N2) 中 2 XCHA- p+2×4.76 p+2×4.76 XN2-1-XCH4-X02 ■ 实验:上述预混气体在开口玻璃管中形成静止火焰(定常问题) 电脑 采用质量流量计配 相机 气,使得CH4,N2: 02间的质量流量之 比为XcH4:XN2:Xo20 99 火焰 玻璃管 质量 气体混合容器 流量器 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 20
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 例题:实验气体配置 20 实验设计,CH4/air混合气体,当量比为=0.8 CH4 + 2(O2 + 3.76N2) 实验II:上述预混气体在开口玻璃管中形成静止火焰(定常问题) 76.42 4 xCH = 76.422 2 xO = N 2=1 CH xxx O24 采用质量流量计配 气,使得CH4,N2, O2间的质量流量之 比为xCH4: xN2: xO2

例题:求混合物当量比 ■ 某燃料中含有四种组分:40%C6H14+30%CgH18+25%C6H12 +5%C6H;(质量百分比)。如果空气与该混合燃料的质量比 (简称“空燃比”)为17,则当量比多少? 解:100g燃料中含有0.465 mole C6H14+0.263 mole CaH18+ 0.298 mole CH2+0.064 mole CcHs. ■完全燃烧时,1 mole C6H14对应9.5(1+79/21)=45.23mole空 气;1 mole C8H18对应12.5(1+79/21=59.52mole空气;1 mole C6H12对应9(1+79121)=42.86mole空气;1 mole C6Hg 对应7.5(1+79/21)=35.71mole空气。 ■100g燃料完全燃烧时消耗的空气为51.74*29=1500g。 ■则当量比为=(1:17)/(100:1500)=0.882。 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn)21
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 例题:求混合物当量比 21 某燃料中含有四种组分: 40% C6H14 + 30% C8H18+ 25% C6H12 + 5% C6H6(质量百分比)。如果空气与该混合燃料的质量比 (简称“空燃比”)为17,则当量比多少? 解:100g燃料中含有0.465 mole C6H14+0.263 mole C8H18+ 0.298 mole C6H12 + 0.064 mole C6H6。 完全燃烧时,1 mole C6H14对应9.5(1+79/21)=45.23 mole空 气;1 mole C8H18对应12.5(1+79/21)=59.52 mole空气;1 mole C6H12对应9(1+79/21)=42.86 mole空气;1 mole C6H6 对应7.5(1+79/21)=35.71 mole空气。 100 g燃料完全燃烧时消耗的空气为51.74*29=1500 g。 则当量比为=(1:17)/(100:1500)=0.882