
化学反应 ■ 空气:21%02+79%N2.1mole02对应79/21=3.76 mole N2 ■因此燃料和空气反应通常写成:Fuel+(O2+3.76N2)。 ■燃料和氧化剂正好完全燃烧: ●CH4+202+7.52N2→C02+2H20+7.52N2 ●H2+0.502+1.88N2→H20+1.88N2 ●CxHy02+(x+0.25y-0.5z02+3.76N2) →xC02+0.5yH20+3.76(x+0.25y-0.5z)N2 其中CxH,O为碳氢燃料的通用表达式 完全燃烧1 mole C,H.(0z需要(x+0.25y-0.5z)mole02, 对应空气为4.76(x+0.25y-0.5z)mole。 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 12
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 化学反应 12 空气:21%O2+79%N2。1 mole O2对应79/21=3.76 mole N2 因此燃料和空气反应通常写成:Fuel + (O2 + 3.76N2)。 燃料和氧化剂正好完全燃烧: CH4 + 2O2 + 7.52N2 → CO2 + 2H2O + 7.52N2 H2 + 0.5O2 + 1.88N2 → H2O + 1.88N2 CxHyOz + (x+0.25y-0.5z)(O2+3.76N2) → xCO2 + 0.5yH2O + 3.76(x+0.25y-0.5z)N2 其中CxHyOz为碳氢燃料的通用表达式 完全燃烧1 mole CxHyOz需要(x+0.25y-0.5z) mole O2, 对应空气为4.76(x+0.25y-0.5z) mole

化学反应当量比 化学反应当量比中: F燃料Fuel),A空气(Air),O氧气(Oxygen) 实际燃空比 (F/A) (FIA)s= 燃料的量 化学当量燃空比(F/A) 空气的量 其中F/A可以是质量比,也可以是摩尔数之比。 ·由于空气中氧气含量为固定值,因此有:(F/) (F1O) (F/A)(F/O) ■=1时,则燃料与空气/氧气正好完全燃烧(stoichiometric) ■中>1时,则燃料过多而空气/氧气不足(fuel rich)一富燃 ■<1时,则空气/氧气过多而燃料不足(fuel lean)一贫燃 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 13
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 13 化学反应当量比 AF st AF )/( )/( = 化学当量燃空比 实际燃空比 = st OF st OF AF AF )/( )/( )/( )/( = 化学反应当量比 : 空气的量 燃料的量 AF )/( st 其中F/A可以是质量比,也可以是摩尔数之比。 由于空气中氧气含量为固定值,因此有: =1时,则燃料与空气/氧气正好完全燃烧(stoichiometric) >1时,则燃料过多而空气/氧气不足(fuel rich)——富燃 <1时,则空气/氧气过多而燃料不足(fuel lean)——贫燃 F 燃料(Fuel),A 空气(Air),O 氧气(Oxygen)

化学反应当量比 化学反应当量比中: F燃料(Fuel),A空气(Air),O氧气(Oxygen) 实际燃空比 (F/A) 燃料的量 = 化学当量燃空比 (F/A) (F/A)= 空气的量 其中FA可以是质量比,也可以是摩尔数之比。 ·由于空气中氧气含量为固定值,因此有:F/) (F1O) (FI A)s (F1O)s ■过量空气系数是实际燃烧进入的空气质量与理论燃烧所用的空 气质量之比。过量空气系数等于化学反应当量比的倒数 空燃比是混合气的空气质量与燃油质量之比 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 14
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 14 化学反应当量比 AF st AF )/( )/( = 化学当量燃空比 实际燃空比 = st OF st OF AF AF )/( )/( )/( )/( = 化学反应当量比 : 空气的量 燃料的量 AF )/( st 其中F/A可以是质量比,也可以是摩尔数之比。 由于空气中氧气含量为固定值,因此有: 过量空气系数是实际燃烧进入的空气质量与理论燃烧所用的空 气质量之比。过量空气系数等于化学反应当量比的倒数 空燃比是混合气的空气质量与燃油质量之比 F 燃料(Fuel),A 空气(Air),O 氧气(Oxygen)

化学反应当量比 ■ 给定化学反应当量比中,配制燃料CxHO,与空气的混合气: φCxHv0z+(x+0.25y-0.5z02+3.76N2) ■因此燃料、氧气和氮气的体积比摩尔数之比为: :(x+0.25y-0.5z):3.76(x+0.25y-0.5z) ■对应各个组分的体积比为: 中 +4.76(x+0.25y-0.5z) (x+0.25y-0.5z) 尤02= xv2=3.76xo2 p+4.76(x+0.25y-0.5z) 《燃烧学基础》2,化学热力学 陈正(cz@pku.edu.cn) 15
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 15 化学反应当量比 zyx )5.025.0(76.4 xFuel = )5.025.0(76.4 )5.025.0( 2 zyx zyx xO = N 2= 76.3 xx O2 给定化学反应当量比,配制燃料CxHyOz与空气的混合气: CxHyOz + (x+0.25y-0.5z)(O2 + 3.76N2) 因此燃料、氧气和氮气的体积比/摩尔数之比为: : (x+0.25y-0.5z) : 3.76(x+0.25y-0.5z) 对应各个组分的体积比为:
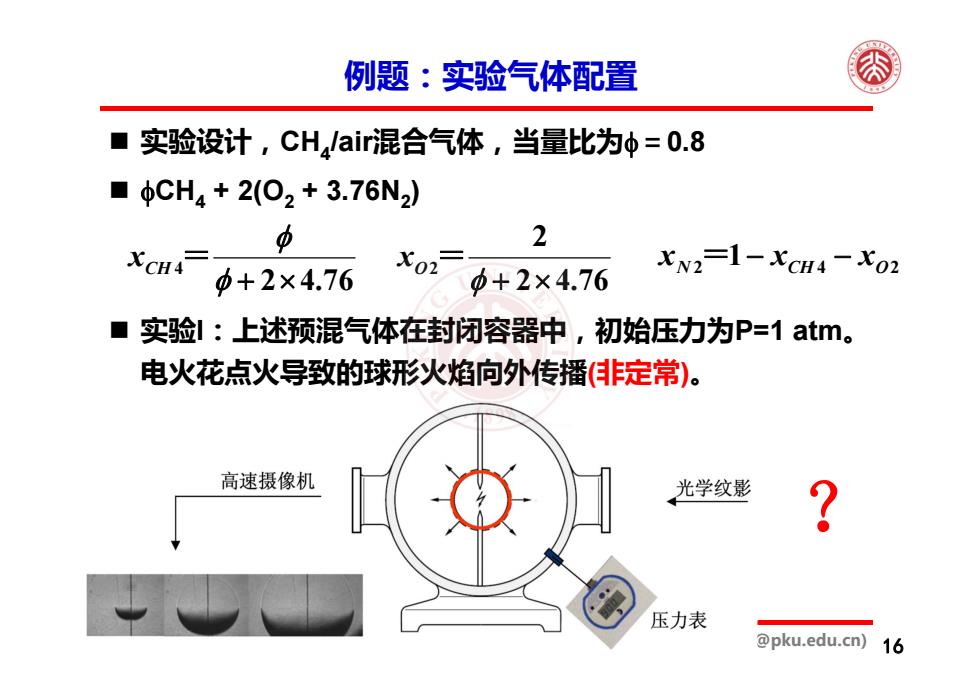
例题:实验气体配置 ■ 实验设计,CH,air混合气体,当量比为中=0.8 ■CH4+2(O2+3.76N2) 中 2 尤cH4 XN2-1-XCH4-X02 +2×4.76 +2×4.76 ■ 实验!:上述预混气体在封闭容器中,初始压力为P=1atm。 电火花点火导致的球形火焰向外传播(非定常): 高速摄像机 光学纹影 压力表 @pku.edu.cn) 16
《燃烧学基础》2,化学热力学 陈正 (cz@pku.edu.cn) 例题:实验气体配置 16 实验设计,CH4/air混合气体,当量比为=0.8 CH4 + 2(O2 + 3.76N2) 76.42 4 xCH = 76.422 2 xO = N 2=1 CH xxx O24 实验I:上述预混气体在封闭容器中,初始压力为P=1 atm。 电火花点火导致的球形火焰向外传播(非定常)。 ?