
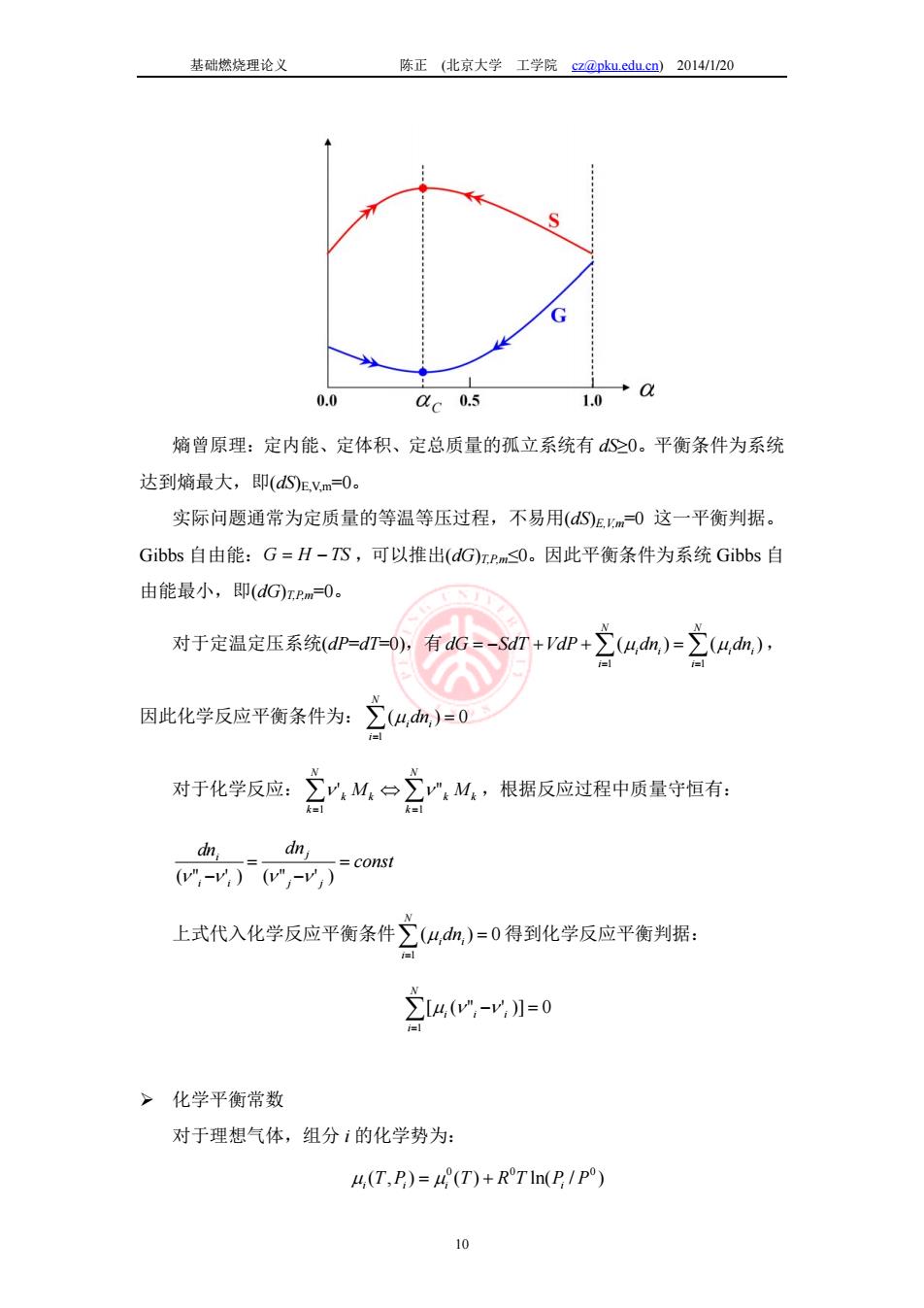
基础燃烧理论义 陈正(比京大学工学院z@pku.edu.cn2014/120 2.2化学平衡 问题:封闭系统中在初始时刻有1 mole CO2,给定压力为P=10am,温度为 T=2500K。假设仅有可逆反应C0,一C0+0.502。问:化学平衡时封闭系统中 C02,C0和O2的摩尔数。 >热力学方程 单组分封闭系统:每个热力学状态量为其它两个状态量的函数。例如, E=E(S,门,P=nRT(n为摩尔数,R为气体常数) 多组分封闭系统:E=ES,V,),其中为m,组分i的摩尔数。组分种类数目为 N. -偿+袋内 TP一化学势= Gs自由能:G=H-,G=-T+P+交ua,4=品 >化学平衡条件 初态(0):1 mole CO2,P=10atm,T=2500K 终态(t→,也称为平衡态):?mole C02/C0/O2,P=10atm,T=2500K 约束条件:化学反应C02一C0+0.502达到平衡态,即熵最大/化学势最低 /Gibbs自由能最低。假设有CO2离解的百分数为a,即有amole CO2经反应生成 C0和02:C02(1-a)C02+cC0+0.5a02。(注:质量守恒和元素守恒自动 满足。)
基础燃烧理论义 陈正 (北京大学 工学院 cz@pku.edu.cn) 2014/1/20 9 2.2 化学平衡 问题:封闭系统中在初始时刻有 1 mole CO2,给定压力为 P=10 atm,温度为 T=2500K。假设仅有可逆反应 2 O2 CO CO 0.5 。问:化学平衡时封闭系统中 CO2,CO 和 O2 的摩尔数。 热力学方程 单组分封闭系统:每个热力学状态量为其它两个状态量的函数。例如, E=E(S,V),P=nR0 T/V (n 为摩尔数,R0 为气体常数)。 多组分封闭系统:E=E(S,V,ni),其中为 ni组分 i 的摩尔数。组分种类数目为 N。 N i S V n i i V n S n dn n E dV V E dS S E dE i i i i j 1 , , , , ( ) ( ) ( ) ( ) V ni S E T , ( ) , S ni V E P , ( ) ,化学势 ( ) , , ( )S V nj j i i i n E N i dE TdS PdV i dni 1 ( ) 焓: H E PV , N i dH TdS VdP i dni 1 ( ), ( ) , , ( )S P nj j i i i n H Gibbs 自由能:G H TS , N i dG SdT VdP i dni 1 ( ), ( ) , , ( )T P nj j i i i n G 化学平衡条件 初态(t=0):1 mole CO2,P=10 atm,T=2500K 终态(t→∞,也称为平衡态):? mole CO2/CO/O2,P=10 atm,T=2500K 约束条件:化学反应 2 O2 CO CO 0.5 达到平衡态,即熵最大/化学势最低 /Gibbs 自由能最低。假设有 CO2 离解的百分数为 α,即有 α mole CO2 经反应生成 CO 和 O2: 2 2 O2 CO (1 )CO CO 0.5 。(注:质量守恒和元素守恒自动 满足。)
基础燃烧理论义 陈正(北京大学工学院z@pku.edu.cn)2014/120 0.0 ac0.5 1.0+a 熵曾原理:定内能、定体积、定总质量的孤立系统有0。平衡条件为系统 达到熵最大,即(dS)Evm-0。 实际问题通常为定质量的等温等压过程,不易用(dSEm0这一平衡判据。 Gibbs自由能:G=H-IS,可以推出(dG)rPm≤O。因此平衡条件为系统Gibbs自 由能最小,即(dG)zPm-0。 对于定温定压系统dP=aT=O.有dG=-SdT+aP+之4dM,)=之(4dM), 因此化学反应平衡条件为: 2=0 对于化学反应:产,从一产,从,根据反应过程中质量守恒有: dn, (-Ψ)(,-,) 上式代入化学反应平衡条件∑(u,dm,)=0得到化学反应平衡判据: 24e-川=0 化学平衡常数 对于理想气体,组分1的化学势为: (T,P)=(T)+RTIn(P/P) 公
基础燃烧理论义 陈正 (北京大学 工学院 cz@pku.edu.cn) 2014/1/20 10 熵曾原理:定内能、定体积、定总质量的孤立系统有 dS≥0。平衡条件为系统 达到熵最大,即(dS)E,V,m=0。 实际问题通常为定质量的等温等压过程,不易用(dS)E,V,m=0 这一平衡判据。 Gibbs 自由能:G H TS ,可以推出(dG)T,P,m≤0。因此平衡条件为系统 Gibbs 自 由能最小,即(dG)T,P,m=0。 对于定温定压系统(dP=dT=0),有 N i i i N i dG SdT VdP i dni dn 1 1 ( ) ( ), 因此化学反应平衡条件为: ( ) 0 1 N i i dni 对于化学反应: N k k k N k k Mk M 1 1 ' " ,根据反应过程中质量守恒有: const dn dn j j j i i i (" ' ) (" ' ) 上式代入化学反应平衡条件 ( ) 0 1 N i i dni 得到化学反应平衡判据: [ ( " ' )] 0 1 N i i i i 化学平衡常数 对于理想气体,组分 i 的化学势为: ( , ) ( ) ln( / ) 0 0 0 i T Pi i T R T Pi P

基础燃烧理论义 陈正(比京大学工学院z@pku.edu.cm2014/120 其中a°为标准状态下(P=p=1aim)纯物质(P=P)的Gibbs自由能。 思考愿:利用上述定义以及G-立小,推导出化学平衡时即O 时,有∑(4,dm,)=0。 将化学势的定义代入化学反应平衡判据立4(-,小=0中,则有 eK.O=p心-yR7 其中K定义为化学(反应)平衡常数,它只是温度的函数,与压力无关。 给定压力P,由于P=xP,因此有: e).P)连 "=K(T)=exp-)(T(RT) 给定摩尔浓度C,由状态方程P,=C,RT,因此有: II(C)-k() RT-) =Kc(T) 其中K。为基于摩尔浓度的化学(反应)平衡常数。在,-V,)=0时有, Kp(T)=Kc(T). 思考题:同一温度下,反应C0+0.502-C02和反应2C0十02-=2C02的化学 反应的平衡常数分别为K1和KP2,请写出K,和K2之间的关系。 >例题 封闭系统中在初始时刻有1 mole CO2,给定压力为P=10am,温度为T= 2500K。假设仅有可逆反应C02一C0+0.502。问:化学平衡时封闭系统中C02 体积百分数xco2=? 解:查表得T=2500K时:48o2=-396152KJ1 Kmole, uco =-327245 KJ/Kmole,on =0 KJ/Kmole
基础燃烧理论义 陈正 (北京大学 工学院 cz@pku.edu.cn) 2014/1/20 11 其中 μi 0 为标准状态下(P=P0 =1 atm )纯物质(Pi=P)的 Gibbs 自由能。 思考题:利用上述定义以及 N i G i ni 1 ( ) ,推导出化学平衡时,即(dG)T,P,m=0 时,有 ( ) 0 1 N i i dni 。 将化学势的定义代入化学反应平衡判据 [ ( " ' )] 0 1 N i i i i 中,则有: ( ) exp{ [( " ' ) ( )]/( )} 0 1 0 ( " ' ) 0 1 K T T R T P P N i P i i i i N i i i 其中 KP定义为化学(反应)平衡常数,它只是温度的函数,与压力无关。 给定压力 P,由于 Pi=xiP,因此有: ( ) exp{ [( " ' ) ( )]/( )} 0 1 0 ( " ' ) 0 ( " ' ) 1 1 K T T R T P P x N i i P i i i N i N i i i i i 给定摩尔浓度 Ci,由状态方程 Pi=CiR0 T,因此有: ( )/ ( ) 1 ( " ' ) 0 0 ( " ' ) 1 K T P R T Ci KP T C N i N i i i i i 其中 KC 为基于摩尔浓度的化学(反应)平衡常数。在 ( " ' ) 0 1 N i i i 时有, K (T ) K (T ) P C 。 思考题:同一温度下,反应 CO+0.5O2=CO2 和反应 2CO+O2=2CO2 的化学 反应的平衡常数分别为 KP1 和 KP2,请写出 KP1 和 KP2 之间的关系。 例题 封闭系统中在初始时刻有 1 mole CO2,给定压力为 P=10 atm,温度为 T= 2500K。假设仅有可逆反应 2 O2 CO CO 0.5 。问:化学平衡时封闭系统中 CO2 体积百分数 xCO2=? 解:查表得 T = 2500K 时 : KJ Kmole CO 396152 / 0 2 , KJ Kmole CO 327245 / 0 , KJ Kmole O 0 / 0 2

基础燃烧理论义 陈正(比京大学工学院z@pk.edu.cn)2014/1/20 对于反应C0,台C0+0.50,有 ((.o68097 KJ Kmole 因此有 K,(T)=ep-立w-)4T】RT)=exp-680978.315x2500 由化学平衡常数的定义以及反应定律P=x,P有 kn- 利用P=10atm和P=latm,有 x xco10 68097 Xco2 =exp(-8315x2500 根据体积百分数的归一性有 X02+xco+Xc02=1 第三个方程根据化学反应C02一C0+0.50,得到: Xco=2X02 联合上述三个方程可以解出:xco2=0.9096。 讨论: 随着压力升高,由于Kr是一常数,因此平衡态xCo2升高,即CO2离解变少。 随着温度升高,K升高,因此平衡态xCam降低,即CO2离解变多。 T1>T2 P
基础燃烧理论义 陈正 (北京大学 工学院 cz@pku.edu.cn) 2014/1/20 12 对于反应 2 O2 CO CO 0.5 有 T KJ Kmole CO CO CO N i i i i [( " ' ) ( )] 0.5 68097 / 0 2 0 0 2 1 0 因此有 ( ) exp{ [( " ' ) ( )]/( )} exp[ 68097 /(8.315 2500)] 0 1 0 K T T R T N i P i i i 由化学平衡常数的定义以及反应定律 Pi=xiP 有 1/ 2 0 2 1/ 2 2 ( " ' ) 0 1 ( ) P P x x x P P K T CO i O CO N i P i i 利用 P=10 atm 和 P0=1 atm,有 ) 8.315 2500 68097 exp( 10 2 1/ 2 2 CO O CO x x x 根据体积百分数的归一性有 xO2 xCO xCO2 1 第三个方程根据化学反应 2 O2 CO CO 0.5 得到: CO 2 O2 x x 联合上述三个方程可以解出:xCO2=0.9096。 讨论: 随着压力升高,由于 KP是一常数,因此平衡态 xCO2 升高,即 CO2 离解变少。 随着温度升高,KP升高,因此平衡态 xCO2 降低,即 CO2 离解变多

基础燃烧理论义 陈正(d比京大学工学院2@pku.ecm)2014/120 >LeChatelier原理: 任何一个初始处于平衡态的系统,当温度或压力发生变化后,它将向最大限 度地减少该变化的方向去改变组分。当压力升高时,则平衡向产生更少的物质量 (摩尔数)的反应方向变化。对于反应C0,一C0+0.50,压力升高时则反应朝 C02生成的方向变化。对于等分子反应(∑("-,)=0),压力没有影响。当温 度升高时,则平衡向吸热反应方向变化。由于C02离解为C0和O2是吸热反应, 因此升高温度会导致更多的C02发生离解。 化学平衡常数的应用:发动机燃烧室内取样,测得压力P以及H、O2、O、 OH的摩尔百分数,问燃烧室内温度T=?(利用化学平衡H+O,台O+OH) >相变平衡Ma一M 相变平衡条件为:。=凸 因此有:d4。=d4 由定义G=立)得:G-2u血+空 由于dG=-SdT+VdP+∑(u,dm,),因此有 立ng)=-ir+n 上述关系对气态和液态均适用,因此有 N dug =-S dT+V dP,dug =-s dT+vdP N du =-S,dT +V dp,du =-s dT+vdf 其中s=S/m,y=V1n 利用d4=d4则有: dP_5- dT vs-vi 13
基础燃烧理论义 陈正 (北京大学 工学院 cz@pku.edu.cn) 2014/1/20 13 Le Chatelier 原理: 任何一个初始处于平衡态的系统,当温度或压力发生变化后,它将向最大限 度地减少该变化的方向去改变组分。当压力升高时,则平衡向产生更少的物质量 (摩尔数)的反应方向变化。对于反应 2 O2 CO CO 0.5 ,压力升高时则反应朝 CO2 生成的方向变化。对于等分子反应( 0 ( " ' ) 1 N i i i ),压力没有影响。当温 度升高时,则平衡向吸热反应方向变化。由于 CO2 离解为 CO 和 O2 是吸热反应, 因此升高温度会导致更多的 CO2 发生离解。 化学平衡常数的应用:发动机燃烧室内取样,测得压力 P 以及 H、O2、O、 OH 的摩尔百分数,问燃烧室内温度 T=? (利用化学平衡H O2 O OH ) 相变平衡 Mgas Mliquid 相变平衡条件为:g l 因此有:dg dl 由定义 N i G i ni 1 ( ) 得: N i i i N i dG i dni n d 1 1 ( ) ( ) 由于 N i dG SdT VdP i dni 1 ( ) ,因此有 n d SdT VdP N i i i 1 ( ) 上述关系对气态和液态均适用,因此有 Ngdg SgdT VgdP ,即dg sgdT vgdP Nl dl Sl dT Vl dP,即dl sl dT vl dP 其中 i Si ni s / , i i i v V / n 利用dg dl 则有: g l g l v v s s dT dP