Cx=0.1000M AgI pX AgBr AgCl 国 AgX pKsp 突跃 加入AgNO3百分数 AgCI 9.74 4.3-5.54 AgBr 12.3 Agl 15.8 ?
AgX pKsp 突跃 AgCl 9.74 4.3-5.54 AgBr 12.3 ? AgI 15.8 ? pX Cx=0.1000 M 加入AgNO3百分数

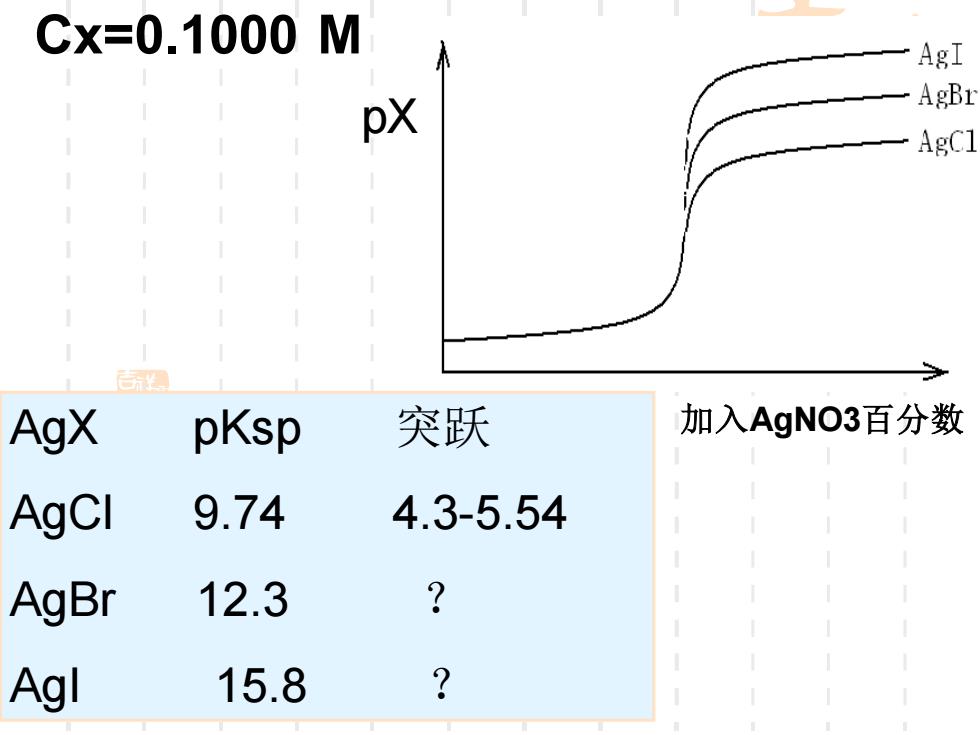
③分步滴定 >理论上一般Ksp1/Kp2≥103可分步 滴定。 先滴定I,后滴定C。 虚 >由于沉淀AgX有吸附作用 和形成混晶,误差大
③分步滴定 ➢理论上一般Ksp1/Ksp2≥103 可分步 滴定。 ➢由于沉淀AgX有吸附作用 和形成混晶,误差大。 先滴定I -,后滴定Cl-

二、银量法指示终点方法(根据指示剂名称命名) (一)铬酸钾指示剂法(Mohr法) 用Ag+滴CI 1.原理: 图 终点前:Ag+CI→AgCI↓(白色) 终点:2Ag*+CrO}→Ag,CrO,↓(砖红色 函
二、银量法指示终点方法 ( 根据指示剂名称命名) (一)铬酸钾指示剂法(Mohr法) 用Ag+滴Cl- 2 4 2 4 2 ( Ag Cl AgCl Ag CrO Ag CrO + − + − + → + → 终点前: (白色) 终点: 砖红色) 1.原理:

KsAgC1=1.8×10-1o s2=1.8×10-10 KapAg2C104=1.2×1012 (2s)2s=1.2×10-12 哪种沉淀溶解度大?
哪种沉淀溶解度大?

2.K2Cr04加入量计算 K2CrO4消耗AgNO3,加的量合适,使误差在C 允许范围内 太大,终点提前,负误差 太小,终点拖后,正误差 设终点体积50mL, 过量0.05%AgNO3,需AgNO3体0×005 积 100 =0.01mL 0.01×0 1=2.0×10M 在溶液中AgNO3浓度:, 50
2. K2CrO4加入量计算 K2CrO4消耗 AgNO3 ,加的量合适,使误差在 允许范围内: 太大,终点提前,负误差 太小,终点拖后,正误差 设终点体积50mL, 过量0.05 %AgNO3,需AgNO3体 积: 在溶液中AgNO3浓度: