
所以电池反应 Zn Cu2+-Cu Zn2+ 不能持续进行。 即不能维持持续的电流
所以电池反应 Zn + Cu2+ —— Cu + Zn2+ 不能持续进行。 即不能维持持续的电流
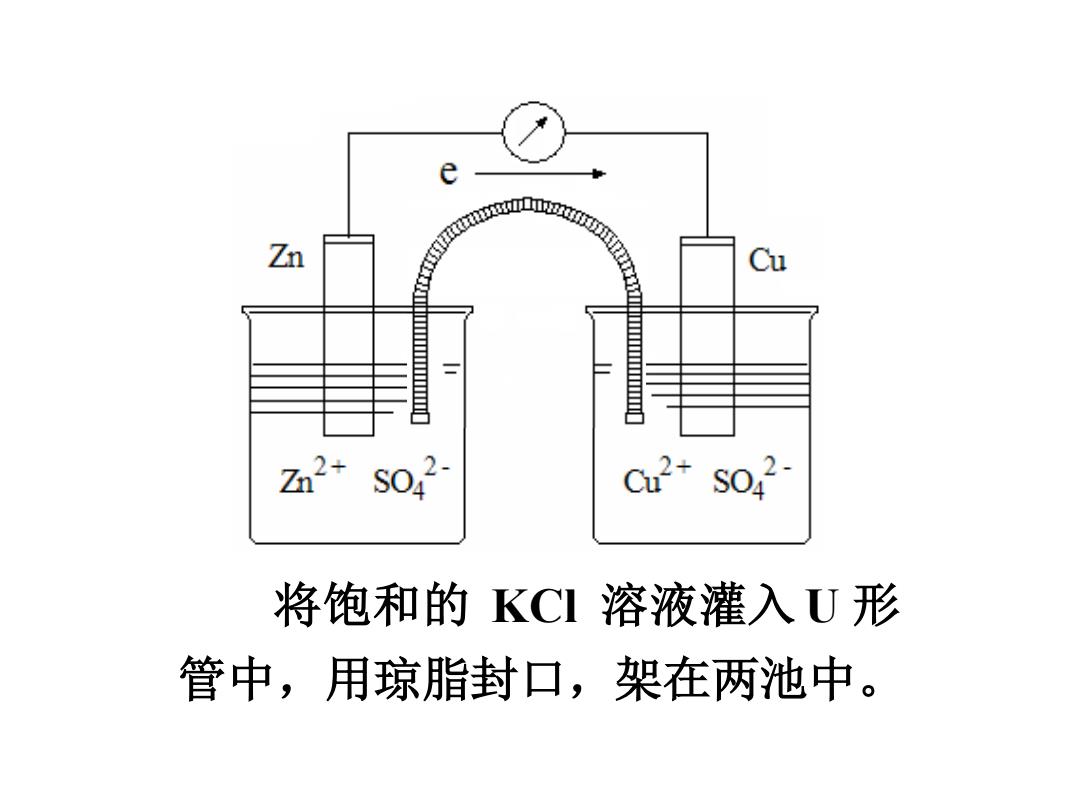
e Zn taa0正8a Cu z2+S042 Cu2+S042- 将饱和的KCI溶液灌入U形 管中,用琼脂封口,架在两池中
将饱和的 KCl 溶液灌入 U 形 管中,用琼脂封口,架在两池中
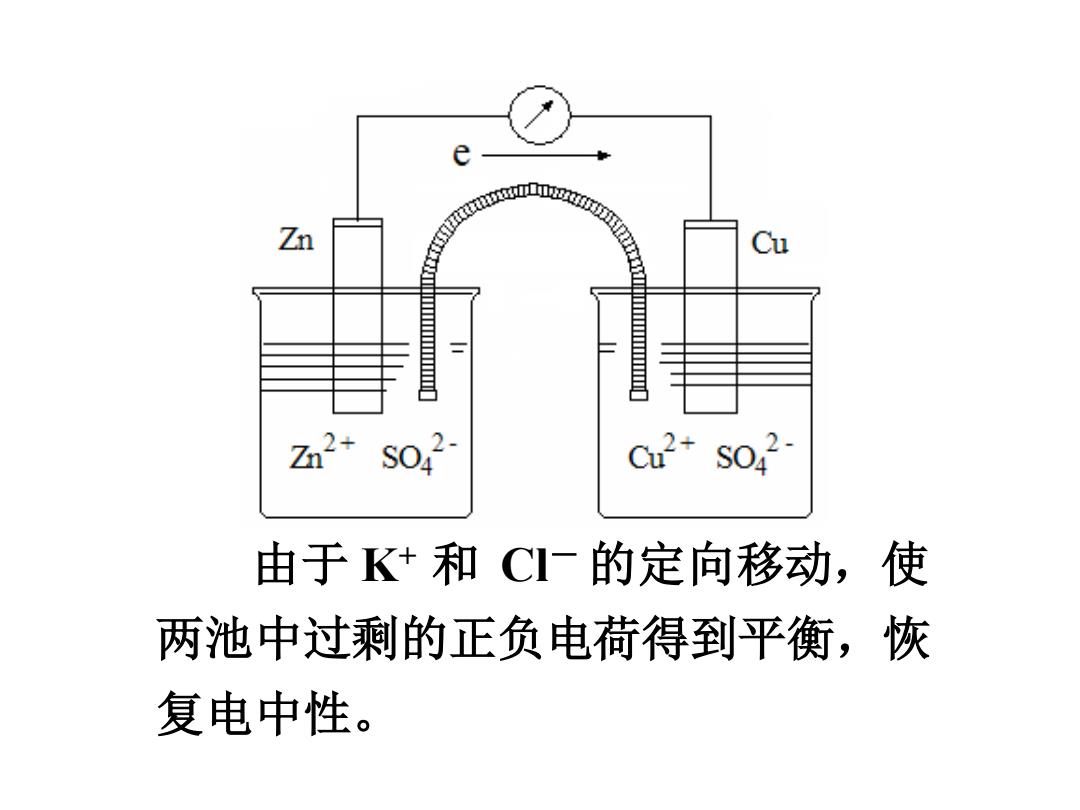
e Zn ★ Cu z2+S042 C2+S042 由于K+和CI一的定向移动,使 两池中过剩的正负电荷得到平衡,恢 复电中性
由于 K+ 和 Cl- 的定向移动,使 两池中过剩的正负电荷得到平衡,恢 复电中性
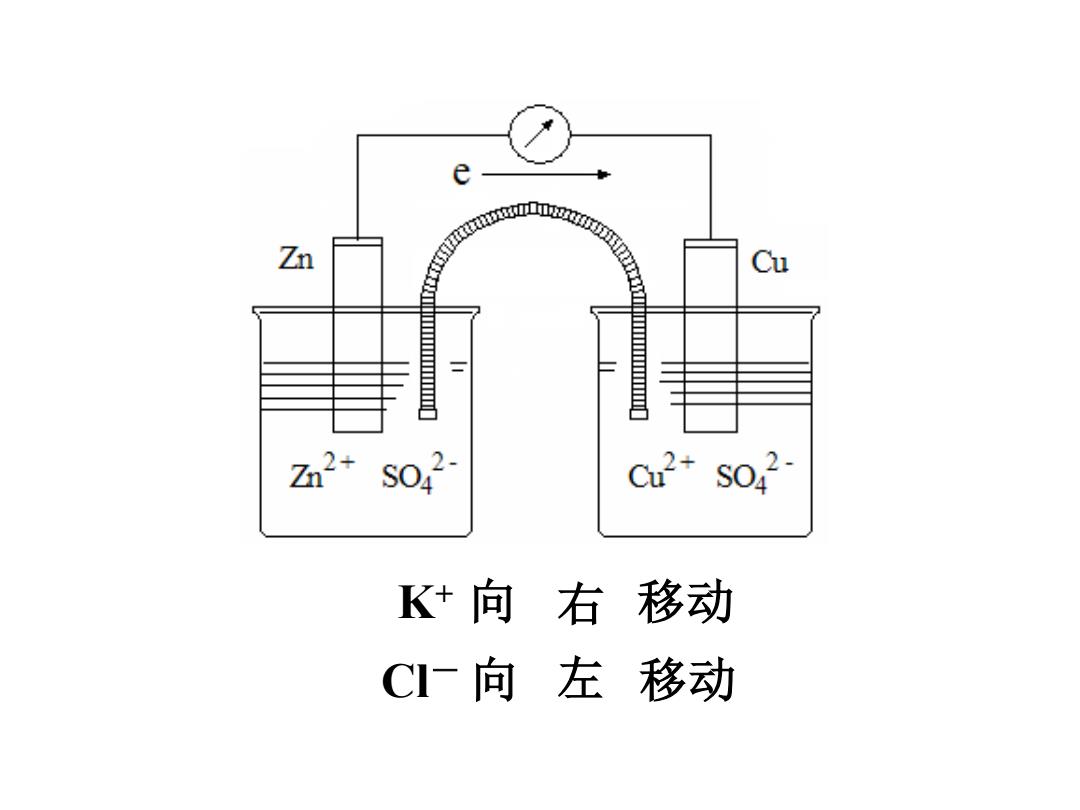
e Zn '。sa Cu Zn2+s C2+S042- K+向右移动 CI一向左移动
K+ 向 左右 移动 Cl- 向 左右 移动 右 左

于是两个半电池反应乃至电池 反应得以继续,电流得以维持。 这就是盐桥的作用
这就是盐桥的作用。 于是两个半电池反应乃至电池 反应得以继续,电流得以维持