
四、缓冲溶液酸度的计算 缓冲溶液一般由弱酸及其共轭碱(如HAc+NaAc)或弱碱 及其共轭酸(如NH3+NH4CI)组成。 1质子条件式: [H+]=[OH+[A]-Cb [HA]=[OH+]-[H+]+C3 2精确计算式为: [H]=K。 [HAY [4] C。-[H]+oH-] =Ka C6+[H]-OH]
四、缓冲溶液酸度的计算 缓冲溶液一般由弱酸及其共轭碱(如HAc + NaAc)或弱碱 及其共轭酸(如NH3 + NH4Cl)组成。 1 质子条件式: [H+] = [OH- ] + [A- ] - Cb [HA] = [OH+] - [H+] + Ca 2 精确计算式为: + − + − − + + − − + = = C H OH C H OH K A HA H K b a a a

3溶液呈酸性(pH<6)时,可忽略[OH+],得近 似计算式: br&. 。-[H] 6+[H+] 4当Ca≥20[H+],C6≥20[H+]时,得最简式 (Henderson缓冲公式) H]上=kC 「共轭碱] pH pKa+lg 「共轭酸1 当溶液呈碱性(pH>8),且Ca≥20[OH],C6≥2 [OH]时,同理可用最简式
3 溶液呈酸性(pH<6)时,可忽略[OH+],得近 似计算式: 4 当Ca≥20 [H+], Cb≥20 [H+]时,得最简式 (Henderson缓冲公式) 当溶液呈碱性( pH>8),且Ca≥20 [OH- ], Cb≥20 [OH- ]时,同理可用最简式。 [ ] [ ] lg 共轭酸 共轭碱 pH = pKa + + + + + − = C H C H H K b a a b a a C C H = K +

例:计算0.10mol/LNH4Cl-0.20mol/LNH3缓冲溶 液的pH值。 解:已知K2=1.8×10-5,K2=K6/Kw=5.6×10-10,由于 NH4CI和NH3的浓度均较大,故可按下式计算: [NH3] pH pKa+log NH 0.20 =9.26+l0g 0.10 =9.56
例:计算0.10 mol / L NH4Cl - 0.20mol / L NH3缓冲溶 液的pH值。 解:已知Kb = 1.8×10-5 ,Ka = Kb / Kw=5.6×10-10,由于 NH4Cl和NH3的浓度均较大,故可按下式计算: 9.56 0.10 0.20 9.26 log log = = + = + + [NH ] [NH ] 4 3 pH pKa

§4-2 酸碱指示剂 指示剂的变色原理 酸碱指示剂(acid-base indicator): 酸碱滴定中用于指示滴定终点的试剂称为酸碱指示剂。 常用的酸碱指示剂是一些有机弱酸或弱碱,这些弱酸 或弱碱与其共轭碱或酸因具有不同结构而颜色不一样。 以酚酞和甲基橙为例
§4-2 酸碱指示剂 一 指示剂的变色原理 酸碱指示剂(acid-base indicator): 酸碱滴定中用于指示滴定终点的试剂称为酸碱指示剂。 常用的酸碱指示剂是一些有机弱酸或弱碱,这些弱酸 或弱碱与其共轭碱或酸因具有不同结构而颜色不一样。 以酚酞和甲基橙为例
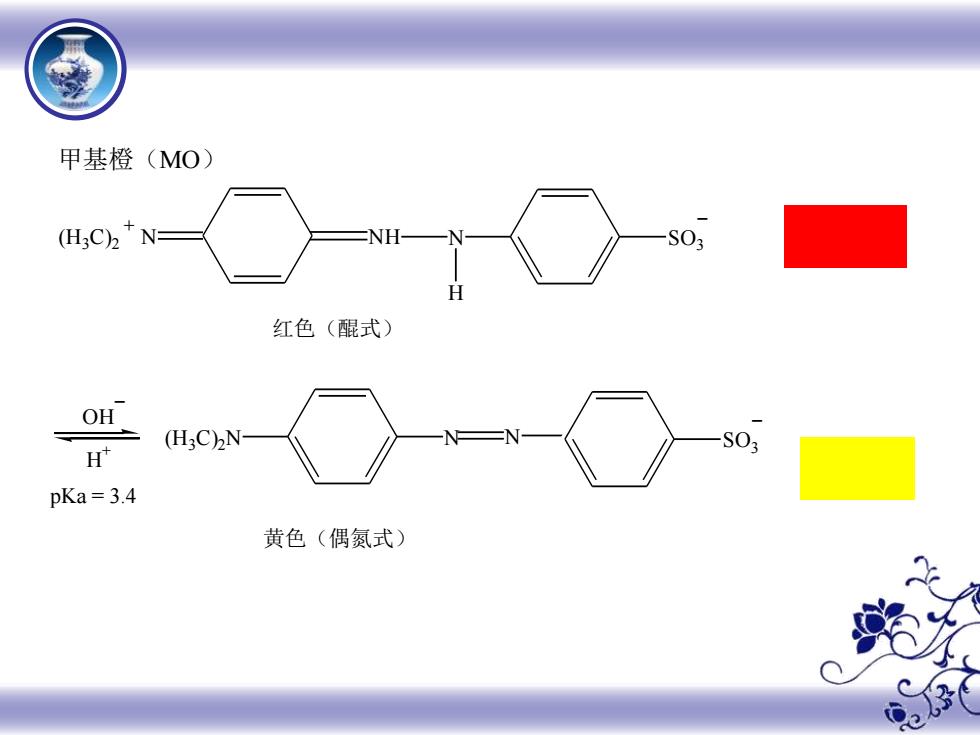
甲基橙(MO) (H3C)2 N S03 红色(醌式) OH SO H (H3C)2N pKa=3.4 黄色(偶氮式) 3
(H3C) 2 + N N NH SO3 OH - - H + (H3C) 2N SO3 - N H N 甲基橙(MO) 红色(醌式) 黄色(偶氮式) pKa = 3.4