
最常见的是催化分解KCIO3 2 KCIO3-2KCI+302 工业上制取O2的方法是液化 空气,然后分馏制氧
最常见的是催化分解 KClO3 2 KClO3 ——— 2 KCl + 3 O2 MnO2 工业上制取 O2 的方法是液化 空气,然后分馏制氧

(2)氧气的性质和用途 常温下,氧气无色无味无臭。 02为非极性分子,不易溶于 极性溶剂H2O
(2) 氧气的性质和用途 常温下,氧气无色无味无臭。 O2 为非极性分子,不易溶于 极性溶剂 H2O

02:-182.95℃液化,成淡 蓝色液体, -1218.79℃凝固,成淡 蓝色固体
− 1218.79 ℃凝固,成淡 蓝色固体。 O2 : − 182.95 ℃ 液化,成淡 蓝色液体
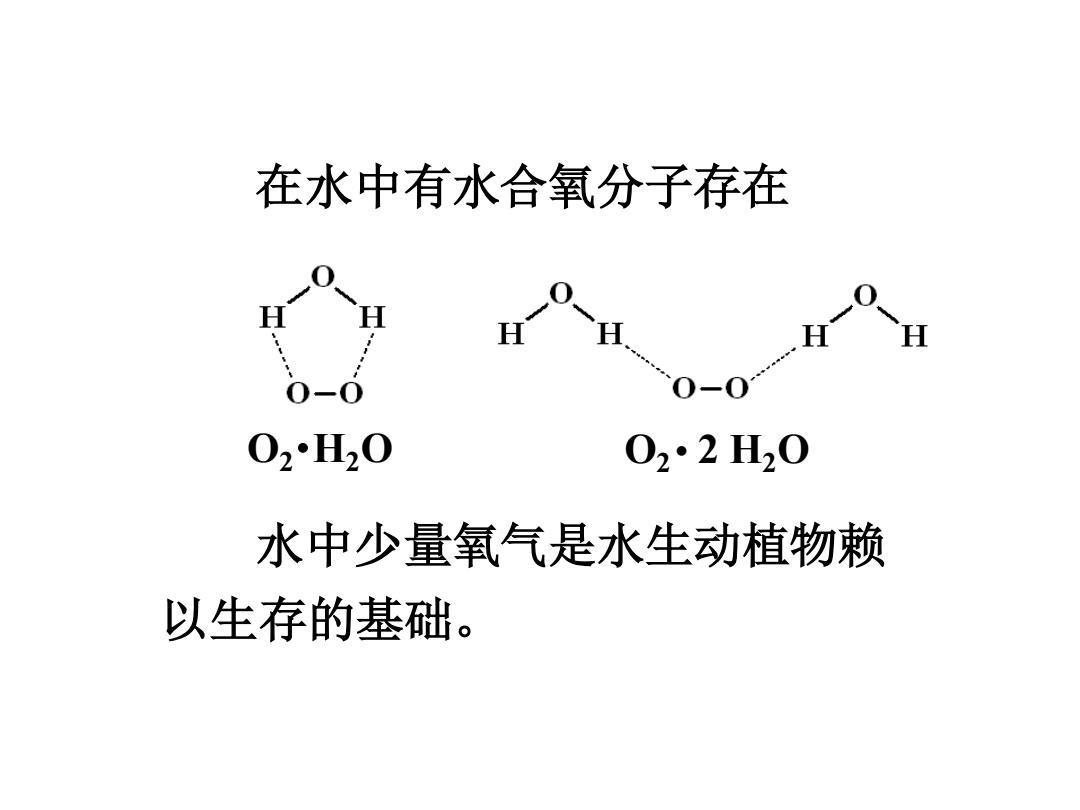
在水中有水合氧分子存在 02H20 02·2H20 水中少量氧气是水生动植物赖 以生存的基础
水中少量氧气是水生动植物赖 以生存的基础。 在水中有水合氧分子存在 O2•H2O O2 • 2 H2O

常温下,氧的化学性质不活泼, 仅能将一些还原性强物质,如KI, SnCl4等氧化
常温下,氧的化学性质不活泼, 仅能将一些还原性强物质,如 KI, SnCl4 等氧化