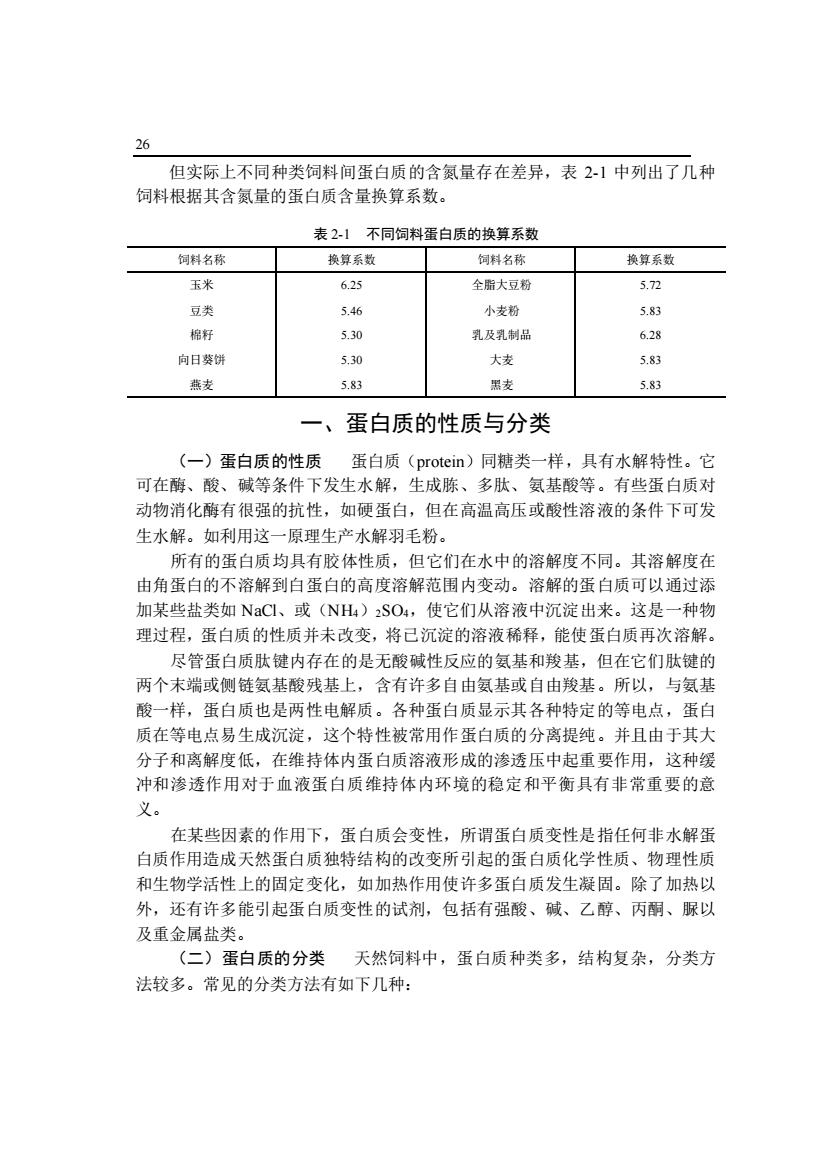
26 但实际上不同种类饲料间蛋白质的含氮量存在差异,表2-1中列出了几种 饲料根据其含氮量的蛋白质含量换算系数。 表21不同饲料蛋白质的换算系数 饲料名称 换算系数 饲料名称 换算系数 玉米 6.25 全脂大豆粉 5.72 豆类 546 小支粉 5.83 格好 5.30 乳及乳制品 6.28 向日葵饼 50 大凌 燕麦 5.83 黑麦 5.83 一、蛋白质的性质与分类 (一)蛋白质的性质蛋白质(protein)同糖类一样,具有水解特性。它 可在酶、酸、碱等条件下发生水解,生成胨、多肽、氨基酸等。有些蛋白质对 动物消化酶有很强的抗性,如硬蛋白,但在高温高压或酸性溶液的条件下可发 生水解。如利用这一原理生产水解羽毛粉。 所有的蛋白质均具有胶体性质,但它们在水中的溶解度不同。其溶解度在 由角蛋白的不溶解到白蛋白的高度溶解范围内变动。溶解的蛋白质可以通过添 加某些盐类如NaCI、或(NH)SO4,使它们从溶液中沉淀出来。这是一种物 理过程,蛋白质的性质并未改变,将已沉淀的溶液稀释,能使蛋白质再次溶解。 尽管蛋白质肽键内存在的是无酸碱性反应的氨基和羧基,但在它们肽键的 两个末端或侧链氨基酸残基上,含有许多自由氨基或自由羧基。所以,与氨基 酸一样,蛋白质也是两性电解质。各种蛋白质显示其各种特定的等电点,蛋白 质在等电点易生成沉淀,这个特性被常用作蛋白质的分离提纯。并且由于其大 分子和离解度低,在维持体内蛋白质溶液形成的渗透压中起重要作用,这种缓 冲和渗透作用对于血液蛋白质维持体内环境的稳定和平衡具有非常重要的意 义。 在某些因素的作用下,蛋白质会变性,所谓蛋白质变性是指任何非水解蛋 白质作用造成天然蛋白质独特结构的改变所引起的蛋白质化学性质、物理性质 和生物学活性上的固定变化,如加热作用使许多蛋白质发生凝固。除了加热以 外,还有许多能引起蛋白质变性的试剂,包括有强酸、碱、乙醇、丙酮、脲以 及重金属盐类。 (二)蛋白质的分类天然饲料中,蛋白质种类多,结构复杂,分类方 法较多。常见的分类方法有如下几种:
26 但实际上不同种类饲料间蛋白质的含氮量存在差异,表 2-1 中列出了几种 饲料根据其含氮量的蛋白质含量换算系数。 表 2-1 不同饲料蛋白质的换算系数 饲料名称 换算系数 饲料名称 换算系数 玉米 6.25 全脂大豆粉 5.72 豆类 5.46 小麦粉 5.83 棉籽 5.30 乳及乳制品 6.28 向日葵饼 5.30 大麦 5.83 燕麦 5.83 黑麦 5.83 一、蛋白质的性质与分类 (一)蛋白质的性质 蛋白质(protein)同糖类一样,具有水解特性。它 可在酶、酸、碱等条件下发生水解,生成胨、多肽、氨基酸等。有些蛋白质对 动物消化酶有很强的抗性,如硬蛋白,但在高温高压或酸性溶液的条件下可发 生水解。如利用这一原理生产水解羽毛粉。 所有的蛋白质均具有胶体性质,但它们在水中的溶解度不同。其溶解度在 由角蛋白的不溶解到白蛋白的高度溶解范围内变动。溶解的蛋白质可以通过添 加某些盐类如 NaCl、或(NH4)2SO4,使它们从溶液中沉淀出来。这是一种物 理过程,蛋白质的性质并未改变,将已沉淀的溶液稀释,能使蛋白质再次溶解。 尽管蛋白质肽键内存在的是无酸碱性反应的氨基和羧基,但在它们肽键的 两个末端或侧链氨基酸残基上,含有许多自由氨基或自由羧基。所以,与氨基 酸一样,蛋白质也是两性电解质。各种蛋白质显示其各种特定的等电点,蛋白 质在等电点易生成沉淀,这个特性被常用作蛋白质的分离提纯。并且由于其大 分子和离解度低,在维持体内蛋白质溶液形成的渗透压中起重要作用,这种缓 冲和渗透作用对于血液蛋白质维持体内环境的稳定和平衡具有非常重要的意 义。 在某些因素的作用下,蛋白质会变性,所谓蛋白质变性是指任何非水解蛋 白质作用造成天然蛋白质独特结构的改变所引起的蛋白质化学性质、物理性质 和生物学活性上的固定变化,如加热作用使许多蛋白质发生凝固。除了加热以 外,还有许多能引起蛋白质变性的试剂,包括有强酸、碱、乙醇、丙酮、脲以 及重金属盐类。 (二)蛋白质的分类 天然饲料中,蛋白质种类多,结构复杂,分类方 法较多。常见的分类方法有如下几种:

27 按生理功能可分为:结构蛋白(如胶原纤维、肌原纤维等)、贮藏蛋白(如 清蛋白、谷蛋白、酪蛋白和生物活性蛋白(如酶、激素等)。 按蛋白分子形状可分为:球蛋白和纤维蛋白。 按加工性状表现可分为:面筋性蛋白(醇溶蛋白、谷蛋白)和非面筋性蛋 白(清蛋白、球蛋白)。 按化学组成,一般多将蛋白质分为:单纯蛋白质、复合蛋白质和衍生蛋白。 l,单纯蛋白质单纯蛋白质(simple protein)是指经彻底水解只产生氨基 酸的蛋白质,若进一步按其溶解性,又可分为7种: (I)清蛋白清蛋白(albumin)又称白蛋白。溶于水、盐酸、碱及稀盐 溶液中。加硫酸铵至饱和时,会从溶液中沉淀析出,遇热凝固。清蛋白广泛存 在于动植物组织中,如血清蛋白、乳清蛋白、豆清蛋白(豌豆中)和麦清蛋白 (小麦中)等。 (2)球蛋白球蛋白(globulin)不溶或微溶于水,但加少量盐、酸或碱 时可缓慢溶解。加硫酸铵至饱和时,可从溶液中沉淀析出。动物球蛋白遇热凝 固,植物球蛋白遇热不凝固。球蛋白广泛存在动植物组织中,如血清球蛋白、 肌球蛋白、棉籽球蛋白、大豆及豌豆球蛋白等。化学组成中以缬氨酸、亮氨酸 精氨酸含量较高,丙氨酸、色氨酸含量一般较低。 (3)谷蛋白谷蛋白(glutelin)不溶于水、盐溶液和乙醇,但溶于稀酸 稀碱溶液,遇热凝固。仅存在植物组织中,如小麦中的麦谷蛋白、大米中的米 谷蛋白等,含谷氨酸较多。 (4)醇溶蛋白醇溶蛋白(prolamin)不溶于水及盐溶液,可溶于10%酒 精中,加热不凝固。仅存在植物体中,如玉米醇溶蛋白、小麦醇溶蛋白等。化 学组成上含脯氨酸较多,赖氨酸、色氨酸一般较少。 (5)精蛋白精蛋白(spermatin)可溶于水和稀酸,能被稀氨水沉淀,遇 热不凝固,属动物性蛋白。鱼精子、卵子和胸腺等组织中含量较高(如鲑精蛋 白等)。化学组成中含赖氨酸、精氨酸较高,不含胱氨酸、谷氨酸。 (6)组蛋白组蛋白(siston)可溶于水和稀酸,能被氨水沉淀。组织中 常与酸性物质结合成盐而存在,加热不凝固,属动物性蛋白。化学组成上组氨 酸、赖氨酸、精氨酸含量较高,酪氨酸含量低。 (7)角硬蛋白角硬蛋白(scleroprotein)在水及盐溶液中不溶,遇热不 凝固。主要存在于动物的表皮、毛、腿、角、软骨等组织中。化学组成上含胱 氨酸、甘氨酸较高。该蛋白难消化,但经高温高压水解或酸碱处理(破坏二硫 基)可供作饲料
27 按生理功能可分为:结构蛋白(如胶原纤维、肌原纤维等)、贮藏蛋白(如 清蛋白、谷蛋白、酪蛋白和生物活性蛋白(如酶、激素等)。 按蛋白分子形状可分为:球蛋白和纤维蛋白。 按加工性状表现可分为:面筋性蛋白(醇溶蛋白、谷蛋白)和非面筋性蛋 白(清蛋白、球蛋白)。 按化学组成,一般多将蛋白质分为:单纯蛋白质、复合蛋白质和衍生蛋白。 1. 单纯蛋白质 单纯蛋白质(simple protein)是指经彻底水解只产生氨基 酸的蛋白质,若进一步按其溶解性,又可分为 7 种: (1)清蛋白 清蛋白(albumin)又称白蛋白。溶于水、盐酸、碱及稀盐 溶液中。加硫酸铵至饱和时,会从溶液中沉淀析出,遇热凝固。清蛋白广泛存 在于动植物组织中,如血清蛋白、乳清蛋白、豆清蛋白(豌豆中)和麦清蛋白 (小麦中)等。 (2)球蛋白 球蛋白(globulin)不溶或微溶于水,但加少量盐、酸或碱 时可缓慢溶解。加硫酸铵至饱和时,可从溶液中沉淀析出。动物球蛋白遇热凝 固,植物球蛋白遇热不凝固。球蛋白广泛存在动植物组织中,如血清球蛋白、 肌球蛋白、棉籽球蛋白、大豆及豌豆球蛋白等。化学组成中以缬氨酸、亮氨酸、 精氨酸含量较高,丙氨酸、色氨酸含量一般较低。 (3)谷蛋白 谷蛋白(glutelin)不溶于水、盐溶液和乙醇,但溶于稀酸、 稀碱溶液,遇热凝固。仅存在植物组织中,如小麦中的麦谷蛋白、大米中的米 谷蛋白等,含谷氨酸较多。 (4)醇溶蛋白 醇溶蛋白(prolamin)不溶于水及盐溶液,可溶于 10%酒 精中,加热不凝固。仅存在植物体中,如玉米醇溶蛋白、小麦醇溶蛋白等。化 学组成上含脯氨酸较多,赖氨酸、色氨酸一般较少。 (5)精蛋白 精蛋白(spermatin)可溶于水和稀酸,能被稀氨水沉淀,遇 热不凝固,属动物性蛋白。鱼精子、卵子和胸腺等组织中含量较高(如鲑精蛋 白等)。化学组成中含赖氨酸、精氨酸较高,不含胱氨酸、谷氨酸。 (6)组蛋白 组蛋白(siston)可溶于水和稀酸,能被氨水沉淀。组织中 常与酸性物质结合成盐而存在,加热不凝固,属动物性蛋白。化学组成上组氨 酸、赖氨酸、精氨酸含量较高,酪氨酸含量低。 (7)角硬蛋白 角硬蛋白(scleroprotein)在水及盐溶液中不溶,遇热不 凝固。主要存在于动物的表皮、毛、腱、角、软骨等组织中。化学组成上含胱 氨酸、甘氨酸较高。该蛋白难消化,但经高温高压水解或酸碱处理(破坏二硫 基)可供作饲料

28 2.复合蛋白复合蛋白(conjugated protein)由单纯蛋白和非蛋白辅基结 合而成。水解时不仅产生氨基酸,而且还会产生其他物质。按辅基不同,复合 蛋白一般又可分为: (l)脂蛋白脂蛋白(lipoprotein)由蛋白质与脂肪或类脂质(磷脂、类 固醇等)结合而成。血、乳、蛋黄、神经及细胞膜中含量较高。 (2)核蛋白核蛋白(nucleoprotein)由单纯蛋白与核酸结合而成。为细 胞核的组分,对动物的生长、繁殖有特殊功能。 (3)糖蛋白糖蛋白(glycoprotein)由蛋白质和碳水化合物组成。如动 物体中的粘蛋白等。 (4)色蛋白色蛋白(chromoprotein)由蛋白质和色素物质组成(以色素 作为辅基)。如叶绿蛋白以镁卟啉为辅基,血红蛋白和细胞色素C以铁卟啉为 辅基。 (5)磷蛋白磷蛋白(phosphoprotein)由蛋白质和磷酸组成。如酪蛋白、 卵黄磷蛋白等。 (6)金属蛋白金属蛋白(metalloprotein)由蛋白质和金属元素组成。如 除蛋白质外,铁蛋白中含Fc(OH)小、细胞色素氧化酶含Fe和Cu、乙醇脱氢酶 含Zn、黄嘌呤氧化酶含Mo和Fe等。 4.衍生蛋白衍生蛋白(derived protein)既包括蛋白质分子内部结构变 化的变性蛋白质,又包括天然蛋白质经酸、碱、酶等处理后所生成的蛋白胨、 月示、肽、明胶等。 二、氨基酸 (一)组成蛋白质的氨基酸及其结构据研究,天然存在的氨基酸(amino acid)约200余种,但常见的组成蛋白质的氨基酸仅20种(编码氨基酸)。由 于氨基酸在种类、数量和排列顺序方面的不同,又组成了自然界多种多样的蛋 白质。天然存在的氨基酸多为易于被动物吸收利用的L型氨基酸。 天然的氨基酸结构上的共同点是都有氨基和羧基,与氨基酸的羧基相连的 碳原子称为a·碳原子,从a-碳原子起依次称B、Y、6、e-碳原子。天然 氨基酸在ā-碳原子有一个氨基,因此也称为a氨基酸。氨基酸的一般结构式 如下: H H
28 2. 复合蛋白 复合蛋白(conjugated protein)由单纯蛋白和非蛋白辅基结 合而成。水解时不仅产生氨基酸,而且还会产生其他物质。按辅基不同,复合 蛋白一般又可分为: (1)脂蛋白 脂蛋白(lipoprotein)由蛋白质与脂肪或类脂质(磷脂、类 固醇等)结合而成。血、乳、蛋黄、神经及细胞膜中含量较高。 (2)核蛋白 核蛋白(nucleoprotein)由单纯蛋白与核酸结合而成。为细 胞核的组分,对动物的生长、繁殖有特殊功能。 (3)糖蛋白 糖蛋白(glycoprotein)由蛋白质和碳水化合物组成。如动 物体中的粘蛋白等。 (4)色蛋白 色蛋白(chromoprotein)由蛋白质和色素物质组成(以色素 作为辅基)。如叶绿蛋白以镁卟啉为辅基,血红蛋白和细胞色素 C 以铁卟啉为 辅基。 (5)磷蛋白 磷蛋白(phosphoprotein)由蛋白质和磷酸组成。如酪蛋白、 卵黄磷蛋白等。 (6)金属蛋白 金属蛋白(metalloprotein)由蛋白质和金属元素组成。如 除蛋白质外,铁蛋白中含[Fe(OH)3]、细胞色素氧化酶含 Fe 和 Cu、乙醇脱氢酶 含 Zn、黄嘌呤氧化酶含 Mo 和 Fe 等。 4. 衍生蛋白 衍生蛋白(derived protein)既包括蛋白质分子内部结构变 化的变性蛋白质,又包括天然蛋白质经酸、碱、酶等处理后所生成的蛋白胨、 月示、肽、明胶等。 二、氨基酸 (一)组成蛋白质的氨基酸及其结构 据研究,天然存在的氨基酸(amino acid)约 200 余种,但常见的组成蛋白质的氨基酸仅 20 种(编码氨基酸)。由 于氨基酸在种类、数量和排列顺序方面的不同,又组成了自然界多种多样的蛋 白质。天然存在的氨基酸多为易于被动物吸收利用的 L 型氨基酸。 天然的氨基酸结构上的共同点是都有氨基和羧基,与氨基酸的羧基相连的 碳原子称为α- 碳原子,从α-碳原子起依次称β、γ、δ、ε-碳原子。天然 氨基酸在α-碳原子有一个氨基,因此也称为α-氨基酸。氨基酸的一般结构式 如下: H H
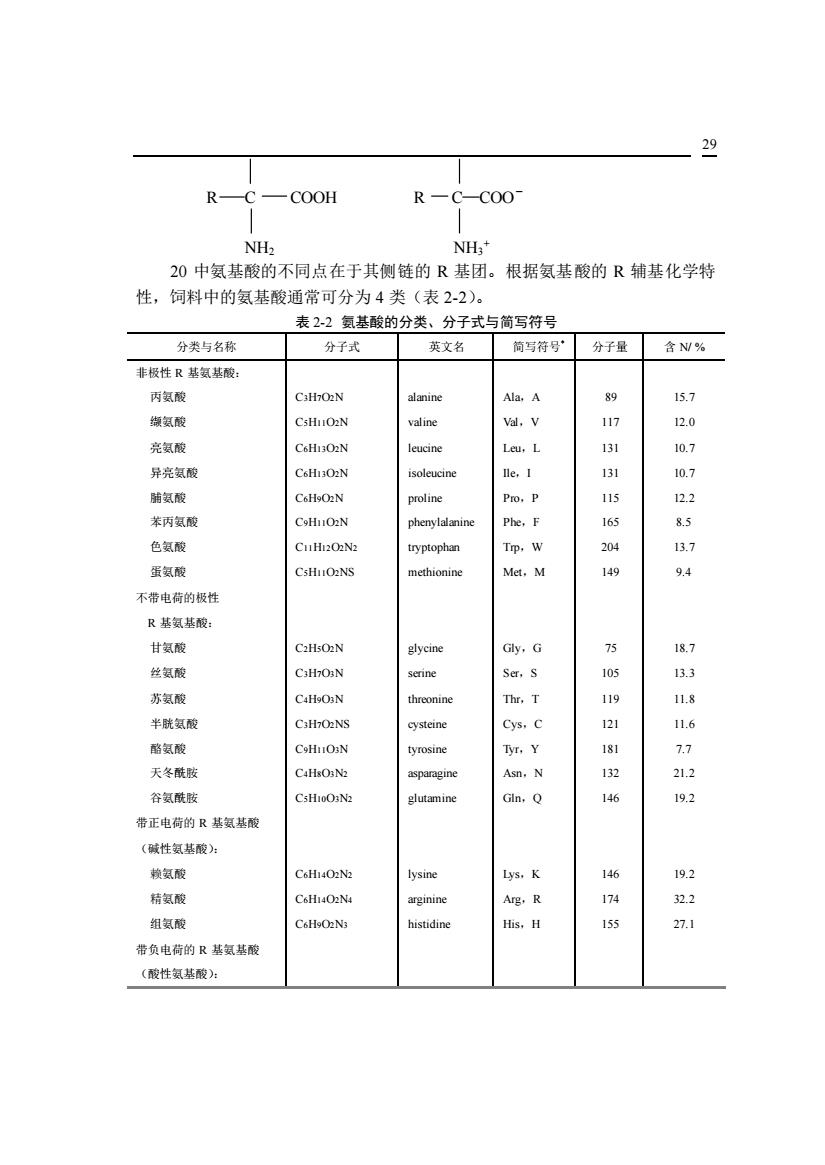
29 R -COOH R-C-COO NHa" 20中氨基酸的不同点在于其侧链的R基团。根据氨基酸的R辅基化学特 性,饲料中的氨基酸通常可分为4类(表2-2)。 表2-2氨基酸的分类、分子式与简写符号 分类与名称 分子式 英文名 简写符号· 分子量含NV% 非极性R基氨基酸 丙氨酸 C:HO2N alanin Ala,A 男 15.7 氨酸 vad.v 亮氨酸 CsHDON Leu,L a 异亮氨酸 ne. 能氨龄 CsHoO2N proe Pro.P 苯丙氨酸 165 85 色氨酸 CUHBON Tp. 蛋氨酸 CsHuO.NS 149 94 不带电荷的极性 R基氨基酸: 甘氨酸 丝氨酸 serine 105 苏氨酸 半酰氨酸 CiHzO2NS Cys, 92 1.6 酪氨酸 B.Y 天冬酰胺 C4HsON2 Asn,N 21.2 谷氨酸肢 lutamin Gln,Q 带正电荷的R基氨基酸 (碱性氨基酸)为 旋氨酸 CsHI4ONz lysine Lys,K 19.2 精氨酸 Arg,R 174 2.2 组氨酸 C6HoO2N3 histidine H面s,H 15 27.1 带负电荷的R基氨基酸 (酸性氨基酸):
29 R C COOH R C COO- NH2 NH3 + 20 中氨基酸的不同点在于其侧链的 R 基团。根据氨基酸的 R 辅基化学特 性,饲料中的氨基酸通常可分为 4 类(表 2-2)。 表 2-2 氨基酸的分类、分子式与简写符号 分类与名称 分子式 英文名 简写符号* 分子量 含 N/ % 非极性 R 基氨基酸: 丙氨酸 C3H7O2N alanine Ala,A 89 15.7 缬氨酸 C5H11O2N valine Val,V 117 12.0 亮氨酸 C6H13O2N leucine Leu,L 131 10.7 异亮氨酸 C6H13O2N isoleucine Ile,I 131 10.7 脯氨酸 C6H9O2N proline Pro,P 115 12.2 苯丙氨酸 C9H11O2N phenylalanine Phe,F 165 8.5 色氨酸 C11H12O2N2 tryptophan Trp,W 204 13.7 蛋氨酸 C5H11O2NS methionine Met,M 149 9.4 不带电荷的极性 R 基氨基酸: 甘氨酸 C2H5O2N glycine Gly,G 75 18.7 丝氨酸 C3H7O3N serine Ser,S 105 13.3 苏氨酸 C4H9O3N threonine Thr,T 119 11.8 半胱氨酸 C3H7O2NS cysteine Cys,C 121 11.6 酪氨酸 C9H11O3N tyrosine Tyr,Y 181 7.7 天冬酰胺 C4H8O3N2 asparagine Asn,N 132 21.2 谷氨酰胺 C5H10O3N2 glutamine Gln,Q 146 19.2 带正电荷的 R 基氨基酸 (碱性氨基酸): 赖氨酸 C6H14O2N2 lysine Lys,K 146 19.2 精氨酸 C6H14O2N4 arginine Arg,R 174 32.2 组氨酸 C6H9O2N3 histidine His,H 155 27.1 带负电荷的 R 基氨基酸 (酸性氨基酸):

30 天门冬氨酸 CaHON aspartic acid Asp,D 133 10.5 容氨酸 CsHoOaN Glu.c 147 9.5 ·列出的简写符号包括三字母符号和单字母符号 (二)氨基酸的理化性质 不同氨基酸在水中的溶解度不同,赖氨酸、 精氨酸易溶于水,胱氨酸、酪氨酸、天冬氨酸等则难溶于水。但所有的氨基酸 都不同程度地可溶于盐酸溶液中。 因为氨基酸分子中存在着氨基和羧基,所以氨基酸是两性化合物,它既具 有碱性基团,又有酸性基团,它既可以不带电荷的分子状态存在,又可以带相 反电荷的偶极离子(或称两性离子)状态存在。还可以前两者的混合物状态存 在。氨基酸在水溶液中以偶极离子状态存在,在强酸性溶液中,大部分氨基酸 以阳离子形式存在,在碱性溶液中则主要呈阴离子状态。对于任何一种氨基酸, 当它存在于一定pH值的溶液中,使其所带静电荷为0时,这个pH值就叫作该 氨基酸的等电点 所有的天然氨基酸中(甘氨酸除外),都存在有不对称的α-碳原子,因此, 都具有旋光性。即有L型和D型2种立体构型。目前发现存在于天然蛋白质中 的氨基酸(除甘氨酸外)都是L型的。但在某些生物体内,特别是细菌中,D 型氨基酸也是广泛存在的。旋光性物质在化学反应中,发生消旋现象并将其转 变为D-型和L型的等当量混合物,称消旋物。用一般的有机合成方法人工合成 氨基酸时,得到的都是无旋光性的DL-消旋氨基酸。 组成蛋白质的20种氨基酸,一般对可见光都没有光吸收,但有几种氨基 酸对紫外光有明显的吸收能力,如酪氨酸、色氨酸和苯丙氨酸。利用这一特性 可以测定这些氨基酸的含量。 此外,氨基酸还有如下化学反应特性: 1氧化脱氨基反应因氧化使氨基酸脱掉氨基而生成ā-酮酸和氨的一种 反应。 RCHNHCOOH+RCOCOOH+NH,1 2.还原脱氨基反应因氢作用使氨基酸脱掉氨基生成有机酸和氨的一种 反应。 RCHNH2COOH十2H→RCH2COOH+NH,↑
30 天门冬氨酸 C4H7O4N aspartic acid Asp,D 133 10.5 谷氨酸 C5H9O4N glutamic acid Glu,C 147 9.5 * 列出的简写符号包括三字母符号和单字母符号 (二)氨基酸的理化性质 不同氨基酸在水中的溶解度不同,赖氨酸、 精氨酸易溶于水,胱氨酸、酪氨酸、天冬氨酸等则难溶于水。但所有 的氨基酸 都不同程度地可溶于盐酸溶液中。 因为氨基酸分子中存在着氨基和羧基,所以氨基酸是两性化合物,它既具 有碱性基团,又有酸性基团,它既可以不带电荷的分子状态存在,又可以带相 反电荷的偶极离子(或称两性离子)状态存在。还可以前两者的混合物状态存 在。氨基酸在水溶液中以偶极离子状态存在,在强酸性溶液中,大部分氨基酸 以阳离子形式存在,在碱性溶液中则主要呈阴离子状态。对于任何一种氨基酸, 当它存在于一定 pH 值的溶液中,使其所带静电荷为 0 时,这个 pH 值就叫作该 氨基酸的等电点。 所有的天然氨基酸中(甘氨酸除外),都存在有不对称的α-碳原子,因此, 都具有旋光性。即有 L-型和 D-型 2 种立体构型。目前发现存在于天然蛋白质中 的氨基酸(除甘氨酸外)都是 L-型的。但在某些生物体内,特别是细菌中,D- 型氨基酸也是广泛存在的。旋光性物质在化学反应中,发生消旋现象并将其转 变为 D-型和 L-型的等当量混合物,称消旋物。用一般的有机合成方法人工合成 氨基酸时,得到的都是无旋光性的 DL-消旋氨基酸。 组成蛋白质的 20 种氨基酸,一般对可见光都没有光吸收,但有几种氨基 酸对紫外光有明显的吸收能力,如酪氨酸、色氨酸和苯丙氨酸。利用这一特性 可以测定这些氨基酸的含量。 此外,氨基酸还有如下化学反应特性: 1.氧化脱氨基反应 因氧化使氨基酸脱掉氨基而生成α-酮酸和氨的一种 反应。 RCHNH2COOH 十 2 1 O2 ⎯→ RCOCOOH 十 NH3↑ 2. 还原脱氨基反应 因氢作用使氨基酸脱掉氨基生成有机酸和氨的一种 反应。 RCHNH2COOH 十 2H ⎯→ RCH2COOH 十 NH3↑