
基础化学(一) 分子的结构和性质 3.共价键的特征 ■共价性 ■共价键结合力的本质是电性的,仍是一种电性 作用,但绝对不是正、负离子间的静电作用。 饱和性: H-CI H-O-H N=N 一个原子,有几个成单价电子,就只能和 几个自旋相反的电子配对成键。 ■H,不能形成H3 2009-6-2
2009-6-2 26 基础化学(一) 分 子 的 结 构 和 性 质 3.共价键的特征 共价性 共价键结合力的本质是电性的, 仍是一种电性 作用,但绝对不是正、负离子间的静电作用 负离子间的静电作用。 饱和性: H-Cl H-O-H N≡N 一个原子,有几个成单价电子,就只能和 几个自旋相反的电子配对成键。 H2不能形成H3
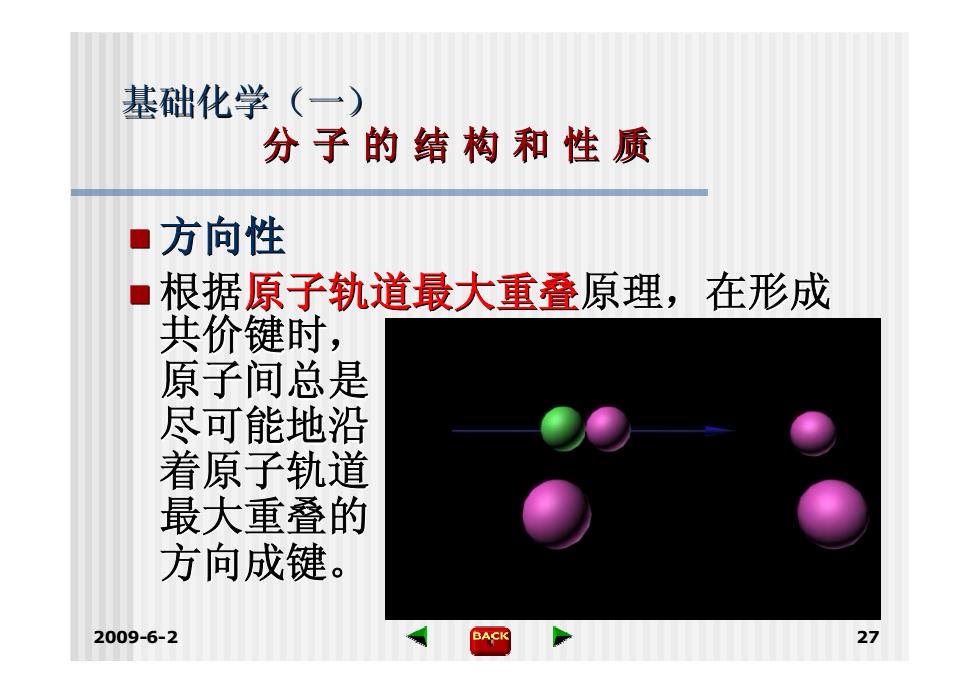
基础化学(一) 分子的结构和性质 ■方向性 根据原子轨道最大重叠原理,在形成 共价键时, 原子间总是 尽可能地沿 着原子轨道 最大重叠的 方向成键。 2009-6-2 BACK
2009-6-2 27 基础化学(一) 分 子 的 结 构 和 性 质 方向性 根据原子轨道最大重叠原理,在形成 共价键时, 原子间总是 尽可能地沿 着原子轨道 最大重叠的 方向成键

基础化学(一) 分子的结构和性质 ■4.原子轨道的重叠 正重叠:自旋相反的两个单电子相互 接近时,由于它们的波函数平符号相 同(“十”与“十”;“一”与“一”),则 原子轨道的对称性匹配,核间的电子 云密集,体系的能量最低,能够形成 稳定的化学键。 2009-6-2 28
2009-6-2 28 基础化学(一) 分 子 的 结 构 和 性 质 4.原子轨道的重叠 正重叠:自旋相反的两个单电子相互 接近时,由于它们的波函数ψ符号相 同(“+”与“+”;“-”与“-”),则 原子轨道的对称性匹配,核间的电子 云密集,体系的能量最低,能够形成 稳定的化学键

基础化学(一) 分子的结构和性质 负重叠:若它们的波函数亚符号不同 (“十”与“一”),则原子轨道对称性 不匹配的重叠相当于上述的排斥态, 不能形成化学键。 2009-6-2 29
2009-6-2 29 基础化学(一) 分 子 的 结 构 和 性 质 负重叠:若它们的波函数ψ符号不同 (“+”与“-”),则原子轨道对称性 不匹配的重叠相当于上述的排斥态, 不能形成化学键

基础化学(一) 分子的结构和性质 图6-2对林性条件 对称性匹配 对称性不匹配 2009-6-2 BACK 30
2009-6-2 30 基础化学(一) 分 子 的 结 构 和 性 质 6-2