
rN./1=rNH,/2,或rH.=1.5NH,即氢的消耗速率rH,是氨的生成速率rNH,的1.5倍。 对于多重反应,如[例1-3]乙烯催化氧化制环氧乙烷过程的平行-串联反应、所消耗的 乙烯既生成环氧乙烷,又生成二氧化碳。乙烯的消耗速率心,H,为环氧乙烷的生成速率 心H,o和0.5倍的二氧化碳生成速率rc四,之和。 二、动力学方程 化学反应速率与反应物系的性质、压力力、温度T及各反应组分的浓度c等因素有关 对于气~固相催化反应,还与催化剂的性质有关。因此,对于特定反应(含特定的催化剂) 的反应物系,反应速率可用函数关系表示:r=f(p,T,c)。 在一定的压力和温度条件下,化学反应速率便变成了各反应组分的浓度的函数,这种函 数关系式称为动力学方程或速率方程。 一般液相反应用物质的量浓度表示动力学方程中反应 物系的组成。对于连续系统气相反应,则由于反应器中不同位置处气体的温度、反应混合物 的摩尔流量及体积流量都在变化,采用分压或摩尔分数表示比较方便,高压下的气相反应, 则采用逸度表示为宜。 如果化学反应的反应式能代表反应的真正过程,称为基元反应,它的动力学方程可以从 质量作用定律直接写出。然而,大多数化学反应是由若干个基元反应综合而成称为非基元 反应,其动力学方程需要由实验确定。 如果反应A十%B一L十wM是液相可逆反应,其动力学方程常用幂函数形式的 通式表示如下 rA=kcAc品一kcc四 (1-52) 式中,幕指数及b分别称为正反应速率式中组分A及B的反应级数幂指数l及m 分别称为逆反应速率式中组分L及M的反应级数,幂指数之和n=a+b及n'=1+m称为 正、逆反应的总级数:k:及:为以浓度表示的正、逆反应速率常数,其值取决于反应物系 的性质和反应温度,与反应组分的浓度无关。如果反应速率的单位用kmol/(m3·h)表示, 浓度的单位用kmol/m3表示,n级反应的kc单位为(kmol/m3)1-n·h-1。 如果反应aA十B =L十M是气-固相催化可逆反应,根据不均匀表面吸附理论 导出的动力学方程常用分压或逸度的幂函数形式的通式来表示,即 A=kpp哈此帽一pip馆p (1-53 此时正反应速率式中有产物的分压出现,而逆反应速率式中有反应物的分压出现,并且 以暴指数形式出现的参数a、b、l、m及a'、b、'、m可以是正数或负数,整数或分数 根据均匀表面吸附理论,反应式AA十%B L十MM的气-固相催化反应动力学方 程可采用I,angmuir-Hinshelwood式表示,其通式为 (1-54) 式中,i泛指反应物、产物及惰性组分;K,是Langmuir等温吸附平衡常数,参数m及 9是正整数。 反应达到平衡时,反应速率为零,此时由式(1-52)及式(1-53),可得 K:=ke/k&K。=kp/k。 (1-55) 即正、逆反应速率常数之比为平衡常数K,或K,· 气-固催化反应动力学在本书第二章阐述。 三、温度对反应速率常数影响的异常现象 反应速率常数可理解为反应物系各组分浓度均为1时的反应速率,它是温度的函数,在 23

一般情况下,反应速率常数k与绝对温度T之间的关系可以用Arrhenius经验方程表示,即 k=k如exp(-Rr】 (1-56) 式中,为指前因子,其单位与反应速率常数相同,决定于反应物系的本质:E:为化 学反应活化能,J/mol;R为摩尔气体常数,在此式中取值8.314J/(mol·K)。一般化学反 应的活化能约为4X10~4×105J/mol,多数在6×10~2.4×105J/mol之间,活化能小于 4×10J/mol的反应,其反应速率常常快到不易测定 反应速率常数的单位与反应速率的表示方式有关。大名数均相反应都采用以反应体积为 基准的反应速率表示式,此时称为体积反应速率常数v。对于气固相催化反应或流-固相非 催化反应,常以反应表面或固体质量为基准表示反应速率,相应地称为表面反应速率常数 ks或质量反应速率常数kW,三者之间的关系可按式(1-43)来换算。 反应速率常数的单位还由反应物系组成的表示方法而定。通常以浓度〔、分压力、逸度 f或气相摩尔分数y表示气相反应物系的组成,相应的反应速率常数分别以k、k、k及 ky表示。 在一定温度范围内,反应机理不变,则化学反应活化能的数值不变,反应速率常数的对 数值对1/T标绘是一直线。 如果某一反应的反应速率常数的对数值对1/T标绘是一曲 线,即化学反应活化能的数值随温度而变,如图14所示,这 种情况在气固相催化反应中常有发生。当传质过程对气-固相 催化反应过程的影响未完全消除时,就会发生这种情况(详见 第二章),这时所测得的反应速率常数是包括了传质过程影响 在内的总体反应速率常数。当完全消除了传质过程的影响,只 图1-4lnk1/T图 要在所观察的温度范围内,反应机理没有改变,lnkl/T标绘 将改变到图1-4的虚线部分,即化学反应活化能的数值不变。 温度对反应速率常数的影响还有另一种异常现象。例如,硝酸生产中一氧化氯氧化的正 反应速率如果按r=k1p保心,来表示,则反应速率常数k1随温度升高而降低。这是由于 氧化氮氧化反应由下列两个连串反应组成:①NO叠合而成(NO)2,这是一个放热反应 很快达到平衡 其平衡常数K=p(N,/p风,随 温度增高而降低;②(NO)2进一步与氧生成 1.0 N(2,这是整个反应的控制步骤,它的正反应 速率常数是。,则正反应速率 500℃ ro=kP(NO),Po,=%K Pko Po:=k Po Po .4807 307 即正反应速率常数1是。与平衡常数K的乘 Z 440 积,温度升高对K值降低的影响大,导致了 .420℃ -0.5 随温度升高而降低的反常现象。 380℃ 图1-5是S101型S0催化氧化钒催化剂的 lk1/T图,出现多个转折点1)。研究表明: 进口气体组成含SO27%、O211%时,当转化 1m×10 事x<0.60时,转折点Z1温度为470℃随转 化率提高,转折点温度下降,当x=075时: 图15钒催化剂的与反应温度 转折点Z2温度为440℃,当x>0.95时,转折 的关系示意图 .60 0.753 点Z3温度为380℃。实验表明,钒催化剂的活 E.E =0.95 一折点前后活化能:么,乙-转折点 24
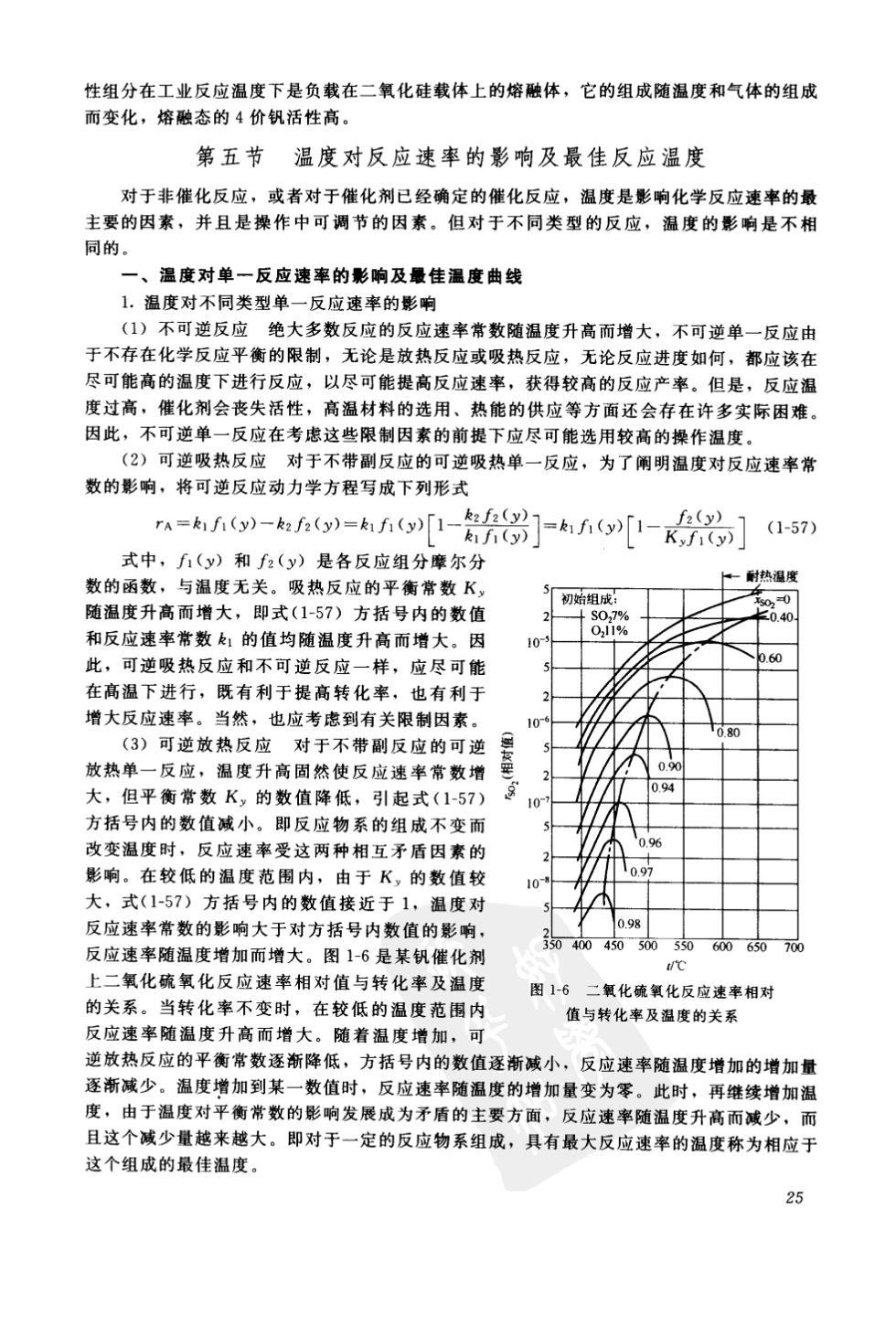
性组分在工业反应温度下是负载在二氧化硅载体上的熔融体,它的组成随温度和气体的组成 而变化,擦融态的4价钒活性高 第五节温度对反应速率的影响及最佳反应温度 对于非催化反应,或者对于催化剂已经确定的催化反应,温度是影响化学反应速率的最 主要的因素,并且是操作中可调节的因素。但对于不同类型的反应,温度的影响是不相 同的。 一、温度对单一反应速率的影响及最佳温度曲线 1.温度对不同类型单一反应速率的影响 (1)不可逆反应绝大多数反应的反应速率常数随温度升高而增大,不可逆单一反应由 于不存在化学反应平衡的限制,无论是放热反应或吸热反应,无论反应进度如何,都应该在 尽可能高的温度下进行反应,以尽可能提高反应速率,获得较高的反应产率。但是,反应温 度过高,催化剂会丧失活性,高温材料的选用、热能的供应等方面还会存在许多实际困难 因此,不可逆单一反应在考虑这些限制因素的前提下应尽可能选用较高的操作温度。 (2)可逆吸热反应对于不带副反应的可逆吸热单一反应,为了阑明温度对反应速率常 数的影响,将可逆反应动力学方程写成下列形式 f(y) 式中,(y)和f2(y)是各反应组分摩尔分 数的函数,与温度无关。吸热反应的平衡常数K, ←耐热温度 初始组成 随温度升高而增大,即式(1-57)方括号内的数值 和反应速率常数!的值均随温度升高而增大。因 此,可逆吸热反应和不可逆反应一样,应尽可能 在高温下进行,既有利于提高转化率,也有利于 增大反应速率。当然,也应考虑到有关限制因素。 (3)可逆放热反应对于不带副反应的可逆 放热单一反应,温度升高固然使反应速率常数增 大,但平衡常数K,的数值降低,引起式(1-57) 方括号内的数值减小。即反应物系的组成不变而 改变温度时,反应速率受这两种相互矛盾因素的 影响。在较低的温度范围内,由于K,的数值较 大,式(1-57)方括号内的数值接近于1,泪度对 反应速率常数的影响大于对方括号内数值的影响 0.98 反应速率随温度增加而增大。图1-6是某钒催化剂 5000 40 50055060060700 /℃ 上二氧化硫氧化反应速率相对值与转化率及温度 图1-6二氧化硫氧化反应速率相对 的关系。 当转化率不变时 在较低的温度范围内 值与转化率及温度的关系 反应速率随温度升高而增大。随着温度增加,可 逆放热反应的平衡常数逐渐降低,方括号内的数值逐渐减小,反应速率随温度增加的增加量 逐渐减少。温度增加到某一数值时,反应速率随温度的增加量变为零。此时,再继续增加温 度,由于温度对平衡常数的影响发展成为矛盾的主要方面,反应速率随温度升高而减少,而 且这个减少量越来越大。即对于一定的反应物系组成,具有最大反应速率的温度称为相应于 这个组成的最佳温度 25
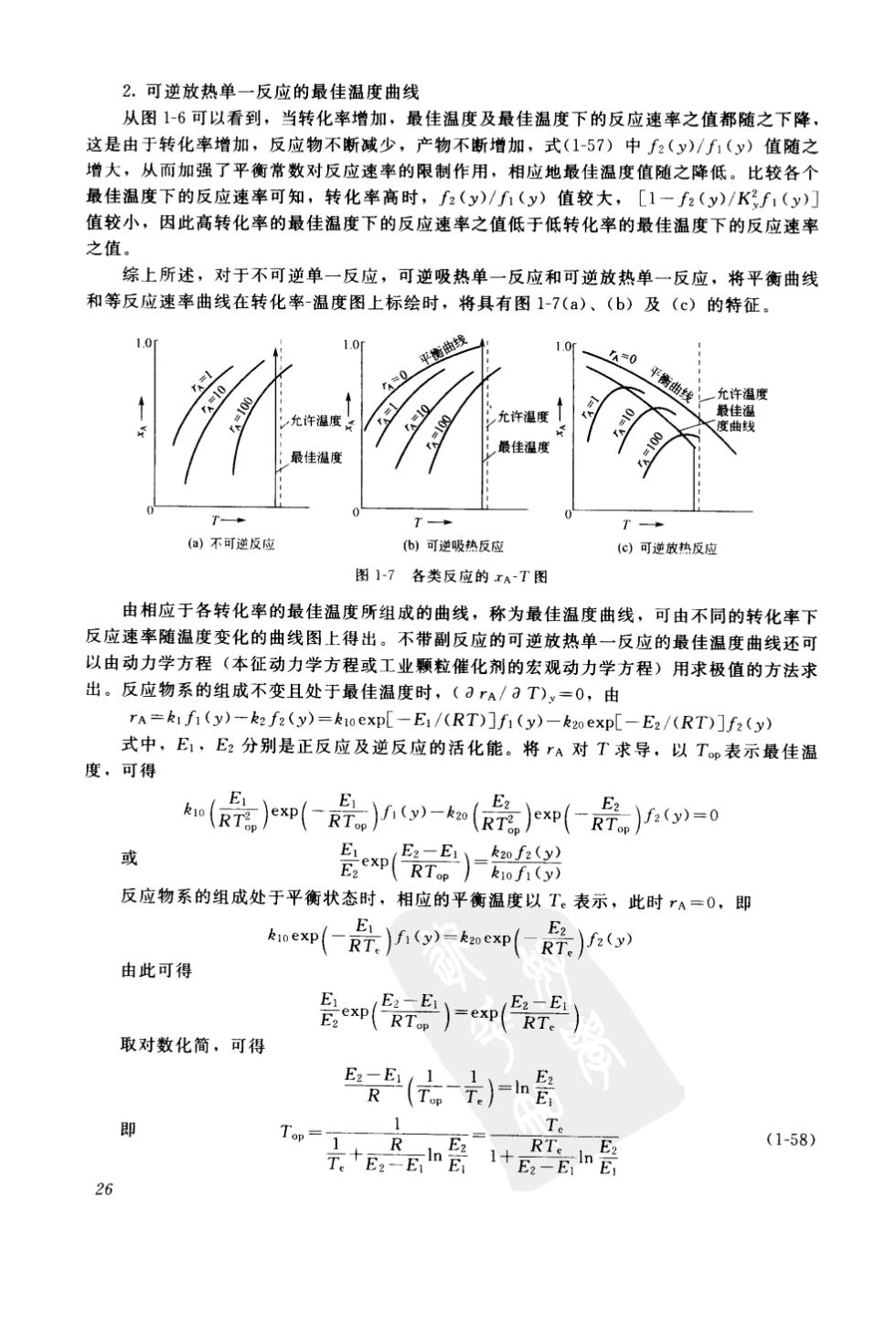
2.可逆放热单一反应的最佳温度曲线 从图1-6可以看到,当转化率增加,最佳温度及最佳温度下的反应速率之值都随之下降 这是由于转化率增加,反应物不断减少,产物不断增加,式(1-57)中2(y)/(y)值随之 增大,从而加强了平衡常数对反应速率的限制作用,相应地最佳温度值随之降低。比较各个 最佳温度下的反应速率可知,转化率高时,f2(y)/(y)值较大,[1一f2(y)/K1(y) 值较小,因此高转化率的最佳温度下的反应速率之值低于低转化率的最佳温度下的反应速率 之值。 综上所述,对于不可逆单一反应,可逆吸热单一反应和可逆放热单一反应,将平衡曲线 和等反应速率曲线在转化率-温度图上标绘时,将具有图1-7(a)、(b)及(c)的特征。 平衡曲线 允许度」 最佳度 T- (a)不可逆反应 ()可逆吸热反应 可逆热反应 图17各类反应的xA~T图 由相应于各转化率的最佳温度所组成的曲线,称为最佳温度曲线,可由不同的转化率下 反应速率随温度变化的曲线图上得出。不带副反应的可逆放热单一反应的最佳温度曲线还可 以由动力学方程(本征动力学方程或工业颗粒催化剂的宏观动力学方程)用求极值的方法求 出。反应物系的组成不变且处于最佳温度时,(rA/3T),=0,由 rA=kIfi(y)-k2fz(y)=k1oexp[-E1/(RT)]fi (y)-k2oexp[-E2/(RT)]f2(y) 式中,E,E2分别是正反应及逆反应的活化能。将rA对T求导,以Tp表示最佳温 度,可得 (是)知(是)w-a(是)是)=0 E2 或 反应物系的组成处于平衡状态时,相应的平衡温度以T。表示,此时rA=O,即 oe即-R是)ig)=kncp(R)a) 由此可得 是cn(k)-p() 取对数化简,可得 E最5(六2)n哥 (1-58) 26
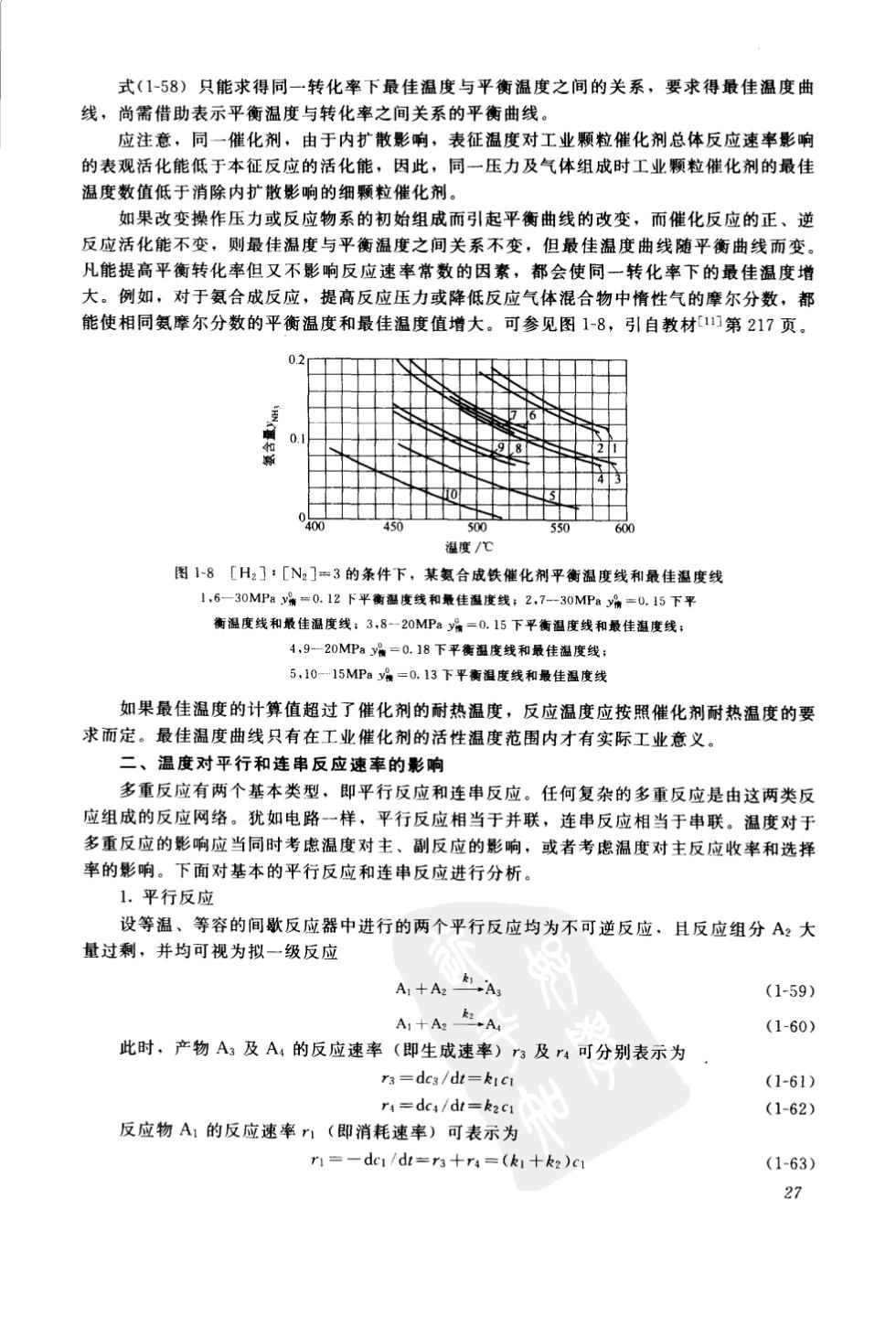
式(1-58)只能求得同一转化率下最佳温度与平衡温度之间的关系,要求得最佳温度曲 线,尚需借助表示平衡温度与转化率之间关系的平衡曲线。 应注章,同一催化剂,由干内扩散影淘,表征祖度对丁业颗粒催化剂总体反应谏率影响 的表观活化能低于本征反应的活化能,因此,同一压力及气体组成时工业颗粒催化剂的最佳 温度数值低于消除内扩散影响的细颗粒催化剂。 如果改变操作压力或反应物系的初始组成而引起平衡曲线的改变,而催化反应的正、逆 反应活化能不变,则最佳温度与平衡温度之间关系不变,但最佳温度曲线随平衡曲线而变。 凡能提高平衡转化率但又不影响反应速率常数的因素,都会使同一转化率下的最佳温度增 大。例如,对于氨合成反应,提高反应压力或降低反应气体混合物中情性气的摩尔分数,都 能使相同氨摩尔分数的平衡温度和最佳温度值增大。可参见图1-8,引自教材第217页。 02 0.1 98 十十 图1-8〔H2]:[N,]=3的条件下,某氨合成铁催化剂平衡温度线和最佳温度线 1,6-30MPay%=0.12下平衡温度线和最佳湿度线:2,7-30MPa4=0.15下平 湿度线和最佳混度线:3,8-一20MP%=0.15下平衡湿度线和最佳度线 4,9一20MP4=0.18下平衡温度线和最佳度线 5,10-15MP:%=0.13下平衡温度线和最佳温度线 如果最佳温度的计算值超过了催化剂的耐热温度,反应温度应按照催化剂耐热温度的要 求而定。最佳温度曲线只有在工业催化剂的活性温度范围内才有实际工业意义。 二、温度对平行和连串反应速奉的影响 多重反应有两个基本类型,即平行反应和连串反应。任何复杂的多重反应是由这两类反 应组成的反应网络。犹如电路一样,平行反应相当于并联,连串反应相当于串联。温度对于 多重反应的影响应当同时考虑温度对主、副反应的影响,或者考虑温度对主反应收率和选择 率的影响。下面对基本的平行反应和连串反应进行分析 1.平行反应 设等温、等容的间歇反应器中进行的两个平行反应均为不可逆反应,且反应组分A2大 量过剩并均可视为拟一级反应 A1十AA (1-59) A1十A2A (1-60) 此时,产物A:及A,的反应速率(即生成速率)方及r可分别表示为 ra=dc3/dt=kIc (1-61) r=dc/dt=kc (1-62) 反应物A的反应速率1(即消耗速率)可表示为 r1=一dc1/d=r3十r4=(k1+k2)c (1-63) 27