
基础化学(一) 原子结构与元素周期性 每一个Ψ(r,0,Φ)所表示的原子 核外电子的运动状态称为原子轨道。 (借用经典力学中“轨道”一词用 之)。 波函数和原子轨道是同义词,都是用 来描述原子核外电子的运动状态的。 波函数确定,原子轨道也随之确定。 ■ 2009-6-2 27
2009-6-2 27 基础化学(一) 原子结构与元素周期性 每一个Ψ( r,θ,Φ)所表示的原子 核外电子的运动状态称为原子轨道。 (借用经典力学中“轨道”一词用 之)。 波函数和原子轨道是同义词,都是用 来描述原子核外电子的运动状态的。 波函数确定,原子轨道也随之确定

基础化学(一) 原子结构与元素周期性 ■5.2.4 四个量子数 求解波函数:得到三个量子数 R(r)→:n(主量子数) Y(0)→:1(副量子数;角量子数) Y(p)→:m(磁量子数) 2009-6-2 28
2009-6-2 28 基础化学(一) 原子结构与元素周期性 5.2.4 四个量子数 磁量子数) 副量子数;角量子数) 主量子数) 求解波函数 得到三个量子数 Y( ) : m( Y( ) : l( ( ) : n( : R r

基础化学(一) 原子结构与元素周期性 ■1.主量子数n 物理意义:主量子数n表示电子离核远 近和轨道能量的高低 ■n值越小,电子离核越近,能量越低 ■n值越大,电子离核越远,能量越高 ■ 取值范围:正整数(n=1,2,3,∞) 2009-6-2 29
2009-6-2 29 基础化学(一) 原子结构与元素周期性 1.主量子数 n 物理意义: 主量子数n表示电子离核远 近和轨道能量的高低 n值越小,电子离核越近,能量越低 n值越大,电子离核越远,能量越高 取值范围: 正整数(n=1,2,3,··· , ∞)
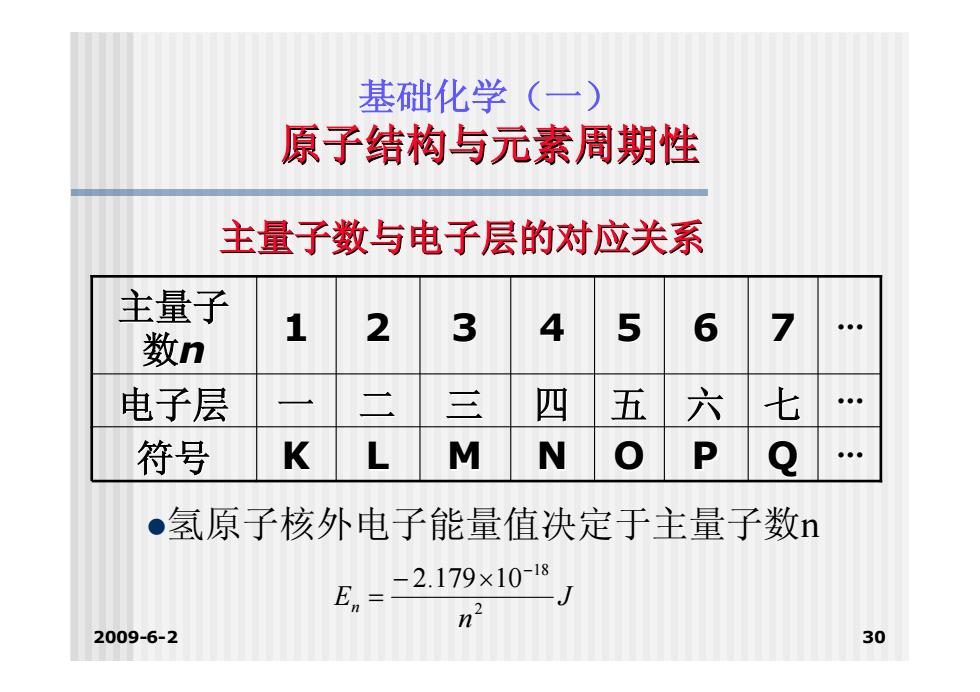
基础化学(一) 原子结构与元素周期性 主量子数与电子层的对应关系 主量子 数n 2 6 电子层 二 三 四 五 六 七 符号 K L M N ●氢原子核外电子能量值决定于主量子数n E= -2.179×10-18 2009-6-2 30
2009-6-2 30 基础化学(一) 原子结构与元素周期性 主量子数与电子层的对应关系 符号 K L M N O P Q ··· 电子层 一 二 三 四 五 六 七 ··· 1 2 3 4 5 6 7 ··· 主量子 数n 氢原子核外电子能量值决定于主量子数n J n En 2 18 2.179 10

基础化学(一) 原子结构与元素周期性 ■2.副(角)量子数: 物理意义: 表示原子轨道或电子云的形状; 表示同电子层中具有不同状态的亚 层; 多电子原子中电子的能量决定于主量 子数n和角量子数l。 取值范围:1=0,1,2,3.n-1 ■取值数目=n值 2009-6-2 31
2009-6-2 31 基础化学(一) 原子结构与元素周期性 2.副(角)量子数l: 物理意义: 表示原子轨道或电子云的形状; 表示同电子层中具有不同状态的亚 层; 多电子原子中电子的能量决定于主量 子数n和角量子数l。 取值范围: l=0,1,2,3. n-1 取值数目 = n值