
基础化学(一) 原子结构与元素周期性 ()核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; ■(2)通常,电子处在离核最近的轨道上,能 量最低—基态;原子获得能量后,电子 被激发到高能量轨道上,原子处于激发 态; (3)从激发态回到基态释放光能,光的频率 v取决于轨道间的能量差。 2009-6-2 12
2009-6-2 12 基础化学(一) 原子结构与元素周期性 (1)核外电子只能在有确定半径和能量的轨 道上运动,且不辐射能量; (2)通常,电子处在离核最近的轨道上,能 量最低— — 基态;原子获得能量后,电子 被激发到高能量轨道上,原子处于激发 态; (3)从激发态回到基态释放光能,光的频率 ν取决于轨道间的能量差

基础化学(一) 原子结构与元素周期性 7=3 原子核 =2 hv=E2-E E2-E1 V= h 能量 n=4 =2 V: 频率 13.6eV2 = 0E: 轨道能量 h:Planck常数 2009-6-2 13
2009-6-2 13 基础化学(一) 原子结构与元素周期性 ν:频率 E:轨道能量 h:Planck常数 h E E h E E 2 1 2 1

基础化学(一) 原子结构与元素周期性 Balmer(巴尔曼)线系 =328910(分 an=3红(Ha) n=4青(Hg) ■n=5蓝紫(Hx)n=6紫(H6) 2009-6-2 14
2009-6-2 14 基础化学(一) 原子结构与元素周期性 Balmer(巴尔曼)线系 1 2 2 15 )s 1 2 1 3.289 10 ( n v n = 3 红(Hα) n = 4 青(Hβ ) n = 5 蓝紫( Hγ)n = 6 紫(Hδ)
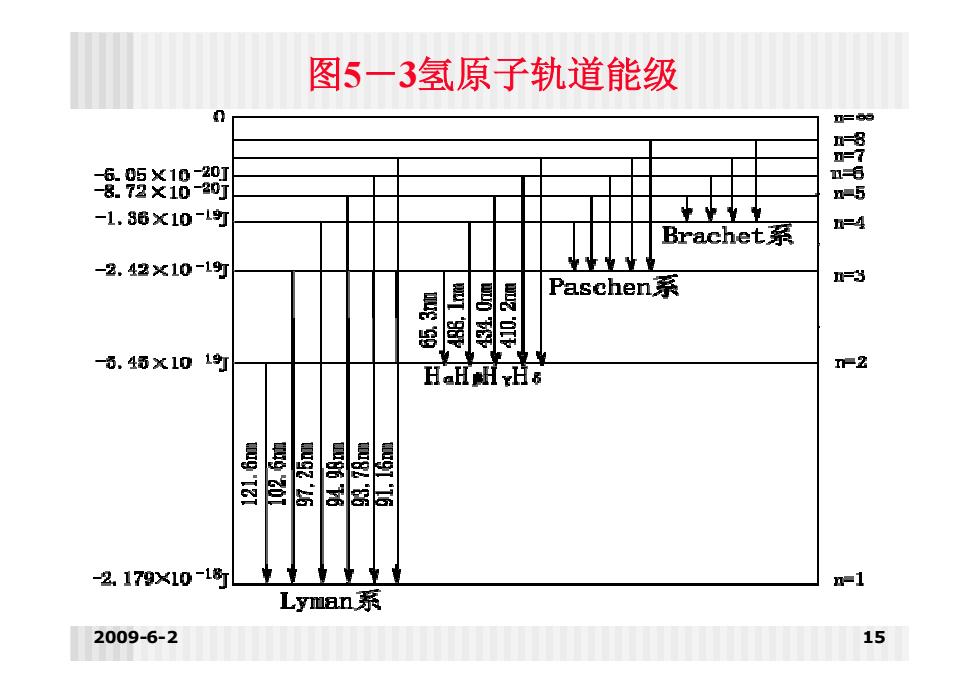
图5一3氢原子轨道能级 景炎18 n-5 -1.86X10-l町 Brachet系 -4 -2.42×10-1斯 Paschen系 =3 月 是 一0.46X10 1钉 HaHAHYHs n-2 昌N 2.179X10-1盼 =1 Lyman.系 2009-6-2 15
2009-6-2 15 图5-3氢原子轨道能级

基础化学(一) 原子结构与元素周期性 波尔理论的特点: ■优点:成功解释了氢原子光谱。 提出了原子轨道的概念。 缺点:不能解释多电子原子的光谱。 (因为:波尔将宏观世界的经典力学 理论搬到了微观世界) 2009-6-2 16
2009-6-2 16 基础化学(一) 原子结构与元素周期性 波尔理论的特点: 优点:成功解释了氢原子光谱。 提出了原子轨道的概念。 缺点:不能解释多电子原子的光谱。 (因为:波尔将宏观世界的经典力学 理论搬到了微观世界)